
题目列表(包括答案和解析)
6.下列物质中含有自由移动的Cl-是
A.KClO3溶液 B.KCl溶液
C.液态HCl D.NaCl固体
5.能够将溶液和胶体区分开的方法是( )
A.过滤 B.观察颜色、状态
C.利用丁达尔效应 D.闻气味
4.下列叙述中正确的是
A.摩尔是物质的质量的单位 B.碳的摩尔质量为12g
C.阿伏加德罗常数约为6.02×1023mol-1 D.一个碳原子的质量为12g
3.现有三组溶液,①汽油和氯化钠溶液;②乙醇和CCl溶液的混合物;③氯化钠和单质碘的水溶液,分离以上各混合物的正确方法依次是: ( )
A、分液、萃取、蒸馏 B、萃取、蒸馏、分液
C、分液、蒸馏、萃取 D、蒸馏、萃取、分液
2.为了使江苏的天更蓝,空气更清新,目前南京市对没有申领到“绿色”通行证的高污染车实行限行。高污染车排出的尾气中所含的污染物除碳氢化合物、可吸入颗粒物、一氧化碳外,还主要含有
A、 二氧化碳 B、氮氧化物
C、 水蒸汽 D、 氮气
1.下列玻璃仪器:①烧杯 ②烧瓶 ③试管 ④容量瓶 ⑤量筒。能直接加热的是:
A.①③ B. ②③ C. ③ D. ④⑤
2. 误差分析:
(1) 润洗
(2) 进气泡
(3) 锥形瓶润洗
(4) 滴定管漏水
(5) 读数角度
(1)称取3.50g试样溶于蒸馏水配成100mL溶液,从中取出10.0mL溶液于锥形瓶中,加2滴指示剂,用0.100mol/LHCl标准溶液滴定至终点,共消耗标准液20.0mL(杂质不与酸反应),求试样中氢氧化钡的物质的量。
(2)另取5.25g试样加热至失去全部结晶水(杂质不分解),称得质量为3.09g,求Ba(OH)2·nH2O中的n值。
(3)试样中Ba(OH)2·nH2O的质量分数为 _____ 。
26、(6分)维生素C(又名抗坏血酸,分子式为C6H8O6,分子量176)具有较强的还原性,放置在空气中易被氧化,其含量可通过在弱酸性溶液中用已知浓度的I2溶液进行测定。该反应的化学方程式如下:C6H8O6+I2 == C6H6O6+2HI,现欲测定某样品中维生素C的含量,具体的步骤及测得的数据如下。取10 mL 6 mol/L CH3COOH溶液,加入100 mL蒸馏水,将溶液加热煮沸后放置冷却。精确称取0.2000 g样品,溶解于上述冷却的溶液中。加入1 mL淀粉指示剂,立即用浓度为0.05000 mol/L的I2溶液进行滴定,共消耗21.00 mL I2溶液。
(1) 为何加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用?
(2) 滴定终点时溶液由___色变为___色
(3) 计算样品中维生素C的质量分数。
(1)在实验室里600℃灼烧MgCl2•6H2O晶体,最后得到的固体物质分别是_________,
原因是_____________________________________________________?.
(2)将PH=12的氢氧化钡溶液和0.01摩/升的盐酸反应,当反应溶液的PH=7时,所消耗的氢氧化钡溶液和盐酸溶液的体积比是_________
(3)物质的量浓度相同的下列溶液:① NaOH②HCl③NaHCO3④Na2CO3⑤NaCl⑥Na2SiO3⑦NH4Cl⑧H2SO4⑨(NH4)2SO4⑩Ba(OH)2 pH由大到小的顺序是:
(4)物质的量浓度相同的下列溶液:① NH4HCO3 ② (NH4)2CO3 ③ KHCO3④K2CO3⑤H2CO3
CO32-的浓度由大到小的顺序是
24、(4分)一杯敞口放置的NaOH溶液,为了证明它是否已经变质(水未蒸发),进行了以下实验:① 取15.00mL该溶液放入锥形瓶中,滴入2-3滴甲基橙指示剂,用1.0000mol/L的标准盐酸滴定,至滴定终点时共用去盐酸22.50mL。②另取15.00mL该溶液放入锥形瓶中,滴入2-3滴酚酞指示剂,用1.0000mol/L的标准盐酸滴定,至滴定终点时共用去盐酸18.75mL。通过计算回答:
上述溶液的组成 及其物质的量浓度 ?
①溶液中c[OH -] c[H +] ② c [HCN] c[CN-]
(2)向碳酸钠的浓溶液中逐滴加入稀盐酸,直到不再生成二氧化碳气体为止,则在此过程中,溶液的碳酸氢根离子浓度变化趋势可能是: (A) 逐渐减小; (B) 逐渐增大; (C) 先逐渐增大,而后减小; (D) 先逐渐减小,而后增大. 你的选择是
(3)pH值相同的 HCl(aq) 、H2SO4(aq) 、CH3COOH(aq)各100 mL
①三种溶液中物质的量浓度最大的是 。
②分别用0.1 mol/L的NaOH(aq)中和,其中消耗NaOH(aq)最多的是 。
③反应开始时,反应速率 。(填A、HCl最快 B、H2SO4最快
C、CH3COOH最快 D、一样快)
(4)某温度下,纯水中的c [H+] = 2.0×10-7 mol/L,则此时c [OH-] = mol/L。相同条件下,测得① NaHCO3(aq) ② CH3COONa(aq) ③ NaClO(aq)三种稀溶液的pH值相同。那么,它们的物质的量浓度由大到小的顺序是 。
22、(7分)25℃时,氢硫酸氢钾溶液里存在着下列平衡:
(a) HS-
+ H2O 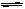 OH- +H2S (b)HS-
OH- +H2S (b)HS-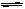 H++S2-
H++S2-
(1)_______是电离平衡;_______是水解平衡。
(2)当向其中加入硫酸铜溶液时,生成了CuS 沉淀,则电离平衡向______________移动;水解平衡向______________移动;c [H+]变(填大或小) ________________;
(3)当向其加入氢氧化钠固体时, c [S2-]变(填大或小)________。
(4)若将溶液加热至沸腾,c[OH -]· c[H +] 将变(大或小)______。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com