
题目列表(包括答案和解析)
2、某透明的强酸性溶液中,不能大量共存的离子组是 ( )
(A) Mg2+、K+、Br-、HCO3- (B) Fe3+、Na+、Cl-、SO42-
(C) NH4+、Na+、NO3-、Cl- (D) K+ 、H+、 Cl-、ClO-
1、下列各组离子能在溶液中大量共存的是 ( )
(A) Na+、HS-、Cu2+、Cl- (B) HS-、Na+、OH-、K+
(C) K+、CO32-、Br-、AlO2- (D) H+、Cl-、Na+、SO32-
3、在碱性溶液中能大量共存且溶液为无色透明的离子组是:
(A) K+、MnO4-、Na+、Cl- (B) K+、Na+、NO3-、CO32-
(C) Na+、HCO3-、NO3-、SO42- (D) Fe3+、Na+、Cl-、SO42-
课堂研究
总结下列离子组不能大量共存的原因:
|
离子组 |
不能共存的原因 |
|
Na+ Ca2+ Cl- F- |
|
|
Cu2+
Na+ S2- Cl- |
|
|
Ag+ K+ F- SO42- |
|
|
H+ K+ SiO32- Cl- |
|
|
H+ Ba2+ I- OH- |
|
|
K+ NH4+ CH3COO- OH- |
|
|
Na+ H+ F- Cl- |
|
|
K+ H+ NO3- HCO3- |
|
|
Na+ Ba+ OH- HCO3- |
|
|
Na+ K+ PO43- H2PO4- |
|
|
K+ Al3+ Cl- HCO3- |
|
|
Na+ Al3+ SO42- AlO2- |
|
|
Ba2+ NH4+ NO3- AlO2- |
|
|
K+
Al3+ Br- S2- |
|
|
K+ Fe3+ SO42- ClO- |
|
|
Fe3+ Ba2+ NO3- SCN- |
|
|
H+
K+ S2- S2O32- |
|
|
Fe3+
NH4+ S2- Cl- |
|
|
H+
Na+ Cl- MnO4- |
|
|
Fe3+
K+ Cl- I- |
|
|
K+
Fe2+ SO42- ClO- |
课后巩固
2、下列各组离子在溶液中能大量共存的是 ( )
(A) Ca2+、HCO3-、Cl-、K+ (B) Fe3+、、NO3-、Na+、I-
(C) Cu2+、Br-、SO42-、S2- (D) Fe3+、Na+、Cl-、SCN-
1、 写出下列反应的离子方程式:
⑴漂白粉溶液中通入少量的二氧化碳气体 。
⑵氢氟酸与KOH溶液反应 。
⑶氢氧化钠溶液中加入少量的碳酸氢钙溶液 。
24(6分)用电子式表示下列化合物的形成过程:
(1)CH4
(2)MgCl2
25(8分)在NaCl、NaOH、N2、H2S中,只含有离子键的是 ,只含有极性键的是 ,只含有非极性键的是 ,既含有离子键又有极性键的是 。
26.(4分)下列实验操作中错误的是(填写序号)_______________________。
A.蒸发操作时,待蒸发皿中的水分完全蒸干后再停止加热
B.将饱和FeCl3溶液滴入沸水中制取Fe(OH)3胶体
C.蒸馏和测定中和反应反应热时,温度计水银球均需浸没在液体中
D.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
E.选用酒精作为萃取剂从碘水中萃取碘。
F.把氢氧化钠固体放在托盘天平左盘的滤纸上称量
G.用酒精灯的外焰给试管中的物质加热
H.过滤操作中,为了加快过滤可用玻璃棒在漏斗中轻轻搅拌
27(10分)利用氧化还原反应2FeCl3+Cu=2FeCl2+CuCl2,设计一个原电池装置。要求:
⑴ 画出装置图,标明电极材料和电解质溶液; ⑵ 写出电极反应式。
28(12分).取含MnO2的软锰矿17.4g与足量浓HCl反应后,将生成的Cl2通入含22g NaBr的水溶液中,经加热蒸发水分并烘干后,得质量为13.1g的残渣。计算:
(1)生成 NaCl多少克?
(2)生成Cl2多少克?
(3)软锰矿含MnO2的质量分数。
20.叙述正确的是( )
A、39K+和40Ca2+微粒中的电子数和中子数都相等
B、D2和He在同温同压时,若体积相等,则质量不相等
C、同一元素的各种同位素的物理性质、化学性质均相同
D、两个质量数和电子数都相等的微粒一定是同种元素
15.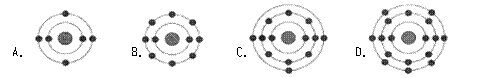 已知最外层电子数相等的元素原子具有相似的化学性质。氟原子的核外电子分层排布示意图为
已知最外层电子数相等的元素原子具有相似的化学性质。氟原子的核外电子分层排布示意图为 ,下列原子中,与氟原子的化学性质相似的是d
,下列原子中,与氟原子的化学性质相似的是d
16随着卤族元素核电荷数的增大,下列递变规律正确的是……………( )
A.单质的颜色逐渐加深
B.单质的熔沸点逐渐降低
C.单质的密度逐渐增大
D.单质在水中的溶解度逐渐增大 .
17关于合金性质的说法中,错误的是 ( d )
A.多数合金的硬度一般比其各成分金属的硬度高
B.多数合金的熔点一般比其各成分金属的熔点低
C.合金的物理性质一般与其各成分金属的的物理性质不同
D.合金的化学性质一般与其各成分金属的的化学性质不同
18一些科学家预言,存在稳定的超重元素,如:N=184的原子,它位于元素周期表第七周期,第ⅣA族.由此,下列说法正确的是………………( )
A.第七周期有50种元素
B.该原子的质子数是184
C.该元素相对原子质量是298
D.该原子核外有114个电子
 19下列电子式正确的是( )
19下列电子式正确的是( )
14.胶体区别于其它分散系的本质特征是:b
A.胶体的分散质能通过滤纸空隙,而浊液的分散质不能。
B.分散质粒子直径在10-9-10-7m之间。
C.产生丁达尔现象。
D.胶体是纯净物,其它分散系是混合物。
13.下列溶液与20mL1mol/LNaNO3溶液中的NO3-物质的量浓度相等的是c
A.5mL1mol/LMg(NO3)2溶液 B.5mL0.8mol/LAl(NO3)3溶液
C.10mL0.5mol/LCu(NO3)2溶液 D.10mL2mol/LAgNO3溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com