
题目列表(包括答案和解析)
3、工业上将苯的蒸气通过赤热的铁合成一种可作传热载体的化合物,该化合物分子中苯环上的一氯代物有3种,1mol该化合物催化加氢时最多消耗6mol氢气,判断这种化合物可能是
( )
A.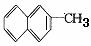 B.
B. 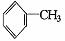
C.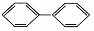 D.
D.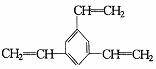
2、下列物质中在通常状况下不能与溴水反应的是 ( )
A、氢氧化钠 B、苯酚
C、乙烯 D、甲苯
1、下列物质可以用分液漏斗分离的是 ( )
A、酒精和碘 B、乙醛和水
C.苯和硝基苯 D、溴苯和水
30.(6分)钙是人体神经、肌肉、骨骼系统、细胞膜和毛细血管通透性的功能正常运作所必需的常量元素,维生素D参与钙和磷的代谢作用,促进其吸收并对骨质的形成和改善有重要的作用。某制药有限公司生产的“钙尔奇D600片剂”的部分文字说明如下:“本品每片含主要成分碳酸钙1.5g(相当于钙元素600mg),成人每天服用1片。”
(1)“1.5g碳酸钙与600mg的钙”的计量关系是如何得出来的,请列式表示。
(2)该公司的另一种产品,其主要成分与“钙尔奇D600”相同,仅仅是碳酸钙的含量不同。为测定该片剂中碳酸钙含量,某学生进行了如下的实验:取一片该片剂碾碎后放入足量的HCl中(假设该片剂的其余部分不与HCl 反应)过滤,取滤液加(NH4)2C2O4,使Ca2+ 生成CaC2O4沉淀,沉淀过滤洗涤后溶解于强酸中,并稀释成1L溶液,取其20mL,然后用0.01mol∙L-1KMnO4 溶液滴定,反应中用去6mLKMnO4溶液,发生的离子反应为:
2MnO4― +5H2C2O4 +6H+ 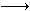 2Mn2+
+10CO2↑+8H2O
2Mn2+
+10CO2↑+8H2O
①请通过计算回答该片剂中碳酸钙的含量。
②你认为该片剂的名称应该叫“钙尔奇D____▲____片剂”。
29.(6分)为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验。
⑴ 若取ag样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为bL。反应的化学方程式是___________▲____________
样品中铝的质量是_____▲_______g。
⑵ 若取ag样品将其点燃,恰好完全反应,该反应的化学方程式是:__________▲__________,氧化铁和铝的质量比是______▲_______。
⑶ 待⑵中反应产物冷却后,加入足量盐酸,测得生成的气体体积为cL,该气体与⑴中所得气体的体积比c:b=_________▲_______
28.(6分)以下是高中化学教材第二册中的一个学生实验,请填写实验报告中的相关内容。
|
实验步骤 |
实验现象 |
解释和结论 |
|
(1)在一个50mL烧杯中放入两块铝片,再加入适量浓硝酸,使铝片浸没在酸液中,观察现象。稍待片刻,用镊子取出铝片,用水洗净表面的酸液。 (2)将用浓硝酸处理过的铝片放入盛有CuSO4溶液的烧杯中,浸泡片刻,观察现象。 (3)然后取出其中一片铝片,用小刀在其表面刻划几下(或用砂纸将其表面打磨干净 ),再放入CuSO4溶液中,观察发生的现象并加以解释。 |
(1) ▲ (2) ▲ (3) ▲ |
(4)本实验可得出的结论: ▲ 。 |
27. (6分)氨跟氧化铜反应可以制取氮气,而氮气跟镁在高温下可得氮化镁, 氮化镁与水反应生成氢氧化镁和氨气。
(6分)氨跟氧化铜反应可以制取氮气,而氮气跟镁在高温下可得氮化镁, 氮化镁与水反应生成氢氧化镁和氨气。
右图装置A、装置B都可用作实验室制氨气,
(1)若选取A装置,则制氨的化学方程式 ▲ _;
(2)选取B装置,则可用 ▲ _和 ▲ _两种常用药品来制取。
(3)以下流程图是某同学提出的制氮化镁的一种实验方案图 (实验前系统内空气已排除)
B中产生的气体 →碱石灰→浓硫酸 →CuO粉末(灼热)→镁粉(高温)→(以下从略)
该方案未能制得氮化镁,你认为其原因是 ▲ _;
请你仿照上述形式,在以下流程图中设计一个实验方案(方框内不一定填满)制氮化镁
B中产生的气体 → ▲ _;→ ▲ _;→ ▲ _;→ ▲ _;→(以下从略)
26.(6分)某化学兴趣小组通过如下实验由表面沾有油污的废铁屑制备FeSO4·7H2O晶体:
①将5% Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2 ~ 3遍;
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50 ~ 80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2 ~ 3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
(1)实验步骤①的目的是 ▲ ,加热能明显提高效果的原因是 ▲ 。
(2)实验步骤②明显不合理,理由是 ▲ 。
(3)实验步骤④中用少量冰水洗涤晶体,用冰水其目的是 ▲ 。
(4)要检验制得的硫酸亚铁晶体是否变质,操作方法是 ▲ 。
24.(6分)某一反应体系有反应物和生成物共五种物质:
O2、H2CrO4、Cr(OH)3、H2O、H2O2
已知该反应中H2O2只发生如下过程:H2O2→ O2
(1)该反应中的还原剂是 ▲ 。
(2)该反应中,发生还原反应的过程是 ▲ → ▲ 。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目
▲ 。
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为 ▲ L。
25(7分).已知NO2和N2O4可以相互转化:2NO2 N2O4(正反应为放热反应)。现将一定量NO2和N2O4的混合气体通入一体积为1L的恒温刚性密闭容器中,各物质的浓度随时间变化关系如下图所示。根据如图所示,回答下列问题:
N2O4(正反应为放热反应)。现将一定量NO2和N2O4的混合气体通入一体积为1L的恒温刚性密闭容器中,各物质的浓度随时间变化关系如下图所示。根据如图所示,回答下列问题:
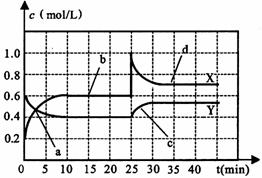
(1)图中共有两条曲线X和Y,其中曲线 ▲ 表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是 ▲ 。
(2)前10min内用NO2表示的化学反应速率v(NO2)= ▲ mol∙L-1∙min-1;反应进行至25min时,曲线发生变化的原因是 ▲ 。
(3)若要达到与最后相同的化学平衡状态,在25min时还可以采取的措施是 ▲ 。
A.加入催化剂 B.缩小容器体积 C.升高温度 D.加入一定量的N2O4
23. (6分)高炉炼铁中Fe2O3+3CO
2Fe+3CO2的反应是一个可逆反应。在19世纪后期,人们发现高炉炼铁所排出的高炉气中含有相当数量的CO,造成原料的浪费,于是工程师们耗费了大量资金增加了高炉的高度,他们为什么设想这样做可提高CO的利用率? ▲ 。后来发现尽管高炉的高度增加了许多,但炉气中CO的量并未有明显减少,这是什么原因?
▲
。
(6分)高炉炼铁中Fe2O3+3CO
2Fe+3CO2的反应是一个可逆反应。在19世纪后期,人们发现高炉炼铁所排出的高炉气中含有相当数量的CO,造成原料的浪费,于是工程师们耗费了大量资金增加了高炉的高度,他们为什么设想这样做可提高CO的利用率? ▲ 。后来发现尽管高炉的高度增加了许多,但炉气中CO的量并未有明显减少,这是什么原因?
▲
。
从这一事情给我们哲学上的启示是什么? ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com