
题目列表(包括答案和解析)
4.可逆反应达到平衡的重要特征是( )
A.反应停止了 B.正逆反应的速率均为零
C.正逆反应都还在继续进行 D.正逆反应的速率相等
3.用铜制取硝酸铜,从节约原料和防止环境污染考虑,最好并可行的方法是( )
A.铜 硝酸铜
硝酸铜
B.铜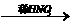 硝酸铜
硝酸铜
C.铜 氯化铜
氯化铜 硝酸铜
硝酸铜
D.铜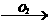 氧化铜
氧化铜 硝酸铜
硝酸铜
2.下列说法正确的是( )
A.在加碘食盐中,碘以单质形式存在
B.纳米材料是指一种称为“纳米”的新物质制成的材料
C.光导纤维是以二氧化硅为主要原料制成的
D.绿色食品是指不含任何化学物质的食品
1. 下列气体中,不会造成空气污染的是( )
A.SO2 B.NO C.N2 D.Cl2
26、(7分)1mol/L AlCl3溶液75mL与2mol/LNaOH溶液120mL混合,可得到Al(OH)3沉淀多少克?
选做题:
金属锡的纯度可以通过下述方法分析:将试样溶于盐酸,反应的化学方程式为: 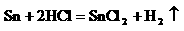 再加入过量的FeCl3溶液,发生如下反应:
再加入过量的FeCl3溶液,发生如下反应:
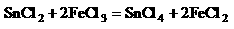
最后用已知浓度的K2Cr2O7溶液滴定生成Fe2+,反应的化学方程式为:
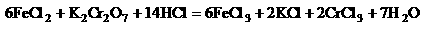
现有金属锡试样0.613g,经上述反应后,共用去0.100mol/L K2Cr2O7溶液16.0ml,试求试样中锡的质量分数(假定杂质不参加反应)。
第一学期期终考试
25、(10分)下图是一套实验室制气装置,用于发生、干燥和收集气体.在NO2、Cl2、SO2、H2S、H2、NO等气体中.该装置可制取、干燥和收集的气体是 .
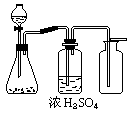
若用上述装置制取该气体,你认为该套装置有何缺点?有何建议?
。
24、(共8分)氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现有0.001mol/L酸性KMnO4和未知浓度的无色NaHSO3溶液,反应离子方程式是2MnO4- + 5HSO3- + H+ ===2Mn2+ + 5SO42- + 3H2O 填空回答问题: (1)该滴定实验所需仪器有下列中的______________________________(填序号) A.酸式滴定管 B.碱式滴定管 C.量筒 D.锥形瓶 E.铁架台 F.滴定管夹 G.烧杯 H.白纸 I.胶头滴管 J.漏斗 (2)滴定前平视KMnO4溶液,刻度为a mL,若滴定后(终点)俯视液面刻度为b mL,则(b-a)mL比实际消耗KMnO4溶液体积_________( 多、少)。根据(b-a)mL计算得到的待测液浓度比实际的浓度_________(大、小)。若滴定后(终点)平视液面刻度为c mL,假设被滴定的未知浓度NaHSO3溶液的体积为V mL,请写出求NaHSO3溶液的物质的量浓度的计算式:___________________________________________________________
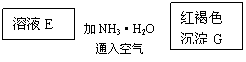
23、(10分)某些金属氧化物跟熔融烧碱反应可生成盐。根据以下化学反应框图填空:
|
|||
 |
|||






|
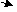


|

|
|

|
|

(1)单质F是_____________
(2)写出由E生成G的离子反应方程式__________________________________________
(3)溶液M中所含金属离子是_____________
 (4)由C E+F的反应中,稀酸I能否改用浓硝酸,为什么?
(4)由C E+F的反应中,稀酸I能否改用浓硝酸,为什么?
___________________________________________________________________________
___________________________________________________________________________
22、(8分)电子表所用的某种钮扣电池的电极材料为Zn和Ag2O,电解质溶液为KOH,其
电极反应式为:Zn+2OH-=ZnO+H2O+2e- Ag2O+H2O+2e-=2Ag+2OH-
电池的负极是______________,正极发生的是_______________反应(反应类型),
总反应式为______________________________________________________________
电池放电时,氧化剂是: (填化学式)氧化产物 (化学式)
21、(7分)在25°C时,纯水中C(H+)·C(OH-)=_________________;
在NH4Cl溶液中C(H+)_____10-7mol/L(大于、小于或等于)pH_____7(大于、小于或等于);
在Na2CO3溶液中C(H+)_____10-7mol/L (大于、小于或等于) pH_____7(大于、小于或等于)
在NaCl溶液中C(H+)_____10-7mol/L (大于、小于或等于) pH_____7(大于、小于或等于);
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com