
题目列表(包括答案和解析)
29.向明矾溶液中滴加Ba(OH)2溶液,当SO42-沉淀完全时,铝元素的存在形式
是( )
A.一部分为Al(OH)3沉淀,一部分以Al3+形式存在于溶液中
B.一部分为Al(OH)3沉淀,一部分以AlO2-形式存在于溶液中
C.全部为Al(OH)3沉淀
D.几乎全部以AlO2-形式存在于溶液中
28.已知:Zn+2Fe3+=Zn2++2Fe2+现将CuSO4、FeCl3和Zn置于水中,充分反应
后,反应器中,所得混和物除SO42-和Cl-外还含有( )
A.Cu、Zn2+、Fe2+ B.Zn2+、Cu2+、Fe2+
C.Zn2+、Cu2+、Fe 、Fe2+ D.Zn2+、Cu2+、Cu、Fe2+
27.下列各组离子加入足量氨水后,现象有明显不同的是( )
①Fe3+、Fe2+ ② Ag+、Al3+ ③ Na+、Ba2+
④ Mg2+ 、Al3+ ⑤ Fe3+、 Al3+ ⑥ Mg2+、Fe2+
A.①②④⑤ B.①②④⑥ C.①②⑤⑥ D.①④⑤⑥
26.CO和O2的混合气100毫升,在一定条件下使其充分反应并恢复到原状况,体积变为88毫升,原混合气体中CO和O2的体积比为( )
A.88:12 B.12:88 C.50:50 D.24:76
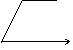
25.下列图中,能表示将氢氧化钡溶液逐滴加入到硫酸铝溶液中,产生沉淀的质量Wg与加入氢氧化钡溶液的体积VmL关系的是( )
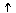

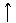
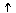





 W
W
W
W
W
W
W
W
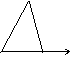
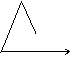

 V
V
V
V
V
V
V
V
A. B. C. D.
24.下列各种变化中,不能通过一步反应就能实现的是( )
A.Al2O3 → AlCl3 B.SiO2 → H4SiO4
C.MgO → Mg(OH)2 D.MgCl2 → Mg
23.下列盛放试剂的方法中,正确的是( )
A.把水玻璃盛放在带玻璃塞的试剂瓶里
B.把氢氧化钠溶液盛放在带玻璃塞的试剂瓶里
C.把氢氟酸盛放在玻璃试剂瓶里
D.把氢氧化钾溶液盛放在带橡皮塞的试剂瓶里
22.下列元素的最高价氧化物的水化物碱性最弱的是( )
A.Na B.Mg C.Al D.Ca
⒈下列关于镁的性质的叙述,错误的是( )
A.能在CO2中燃烧 B.能在空气中燃烧,放出大量热
C.能与碱溶液反应、放出氢气 D.硬度、密度都比铝小
⒉下列液体中加入肥皂水后振荡、不产生沉淀并有较多泡沫的是( )
A.海水 B.食盐水 C.光卤石浸出液 D.流经石灰岩的水
⒊下列各组物质中,晶体类型不同,且前者熔沸点高于后者的是
A.NaCl、金刚石 B.SiH4、CH4
C.SiO2、CO2 D.H2S、H2O
⒋制取下列物质,不直接用石灰石的是( )
A.玻璃 B.生石灰 C.水泥 D.硫酸
⒌学名、俗名(含溶液)、用途不相匹配的是( )
A.硅酸钠、水玻璃、建筑粘接剂
B.碳酸氢钠、苏打、制玻璃
C.二水硫酸钙、石膏、调节水泥凝结时间
D.硫酸铝钾、明矾、净水剂
⒍某硬水中无Ca2+ ,只有Mg2+,若用石灰、纯碱将Mg2+转化为Mg(OH)2↓,Ca2+转化为CaCO3↓,从而达到软化硬水的目的,所加试剂的物质的量的关系最好是( )
A.石灰用量>纯碱用量 B.石灰用量<纯碱用量
C.石灰用量=纯碱用量 D.无法判断
⒎某无色透明溶液能与铝作用放出氢气,此溶液中能大量共存的离子是( )
A.OH-、NO3-、Ba2+、Cl- B.H+、Ba2+ 、Mg2+、NO3-
C.Cu2+、H+、Al3+、SO42- D.Na+、K+、MnO4-、Cl-
⒏能用铝制容器盛装的有( )
A.硫酸铜溶液 B.浓烧碱溶液
C.Na2SiO3溶液 D.69%的硝酸
⒐用生铁冶炼成碳素钢的主要目的是( )
A.用还原剂把氧化亚铁还原成铁
B.适当降低铁里的含碳量、调整钢里合金元素含量,除去大部分硫磷等有害杂质
C.加入各种合金元素,改善铁的性能
D.把生铁提纯,除去生铁中的各种杂质
⒑由Na、Mg、Zn、Al四种金属单质中的两种组成的混合物共12g,跟足量盐酸反应,产生5.6L氢气(标准状况),由此判断混合物中必含有( )
A.Mg B.Al C.Zn D.Na
⒒取一定量的镁-铝合金,用足量盐酸溶解后,再加入过量NaOH溶液然后滤出沉淀物,加热灼烧,最后得到白色粉末,干燥后称量,这些粉末与原合金质量相等,则合金中铝的百分含量为( )
A.40% B.58.6% C.60% D.20%
⒓下列各组中的两种物质,即使按恰当的比例混合仍不能符合下列①至③各条 要求的是( )
① 加过量水形成透明溶液且有气体放出
② 加过量盐酸形成透明溶液且有气体放出
③ 加过量NaOH溶液形成透明溶液且有气体放出
A.Na2O2和Al2O3 B.Mg3N2和SO3
C.P2O3和NH4HCO3 D.Na2O和Al
⒔在100亳升0.1mol/L CuSO4溶液中放入m克薄铁片,反应片刻后将铁片取出 洗净,干燥后称量为(m+0.08克),此时溶液仍为100亳升,则其中Fe2+物质的量浓度为( )
A.1×10-4mol/L B.1×10-3mol/L
C.1×10-2mol/L D.0.1mol/L
⒕ a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种。已知:⑴ a、 c 均能与稀H2SO4反应放出气体;⑵ b与d的硝酸盐反应,置换出单质d;⑶ c 与强碱反应放出气体;⑷ c、e在冷浓硫酸中发生钝化。由此可判断a、b、c、d、e依次为( )
A.Fe、Cu、Al、Ag、Mg B.Al、Cu、Mg、Ag、Fe
C.Mg、Cu、Al、Ag、Fe D.Mg、Ag、Al、Cu、Fe
⒖某结晶水合物化学式为A·xH2O,其式量为B,在60℃时,mg晶体完全溶于ng水中,制得饱和溶液VmL,下列表达式中正确的是( )
A.该饱和溶液中溶质的质量分数为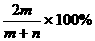
B.该饱和溶液中溶质的量浓度为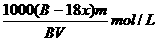
C.60℃时A的溶解度为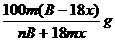
D.该饱和溶液VmL中含溶质mg
⒗ 500mL 1mol/L FeCl3溶液,加入铁粉至还原完全,除去多余铁粉后加足量 NaOH溶液,所得沉淀的物质的量为( )
A.0.5mol B.1mol C.0.75mol D.不能确定
⒘下列物质不属于混合物的是( )
A.铝热剂 B.水泥 C.水玻璃 D.明矾
⒙在下列各组物质中,同一种元素的化合价相同的是( )
A.AlCl3和NaAlO2 B.SiH4和SiO2
C.Fe2O3和FeCl2 D.Mg和Mg(OH)2
⒚下列说法正确的是( )
A.硅的晶体与水晶都属于晶体 B.原硅酸是挥发性酸
C.铝单质广泛存在于自然界中 D.石英和干冰的组成和结构相似
⒛下列物质的晶体熔点最高的是( )
A.二氧化碳 B.二氧化硅 C.铝镁合金 D.硫
21.在地壳中能以游离态存在的元素是( )
A.硅 B.碳 C.铁 D.镁
⒐下列事实不能用勒夏特列原理解释的是( )
A. 由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
B. 黄绿色的氯水光照后颜色变浅
C. 使用催化剂可加快SO2转化为SO3的速率
D. 含有[Fe(SCN)]2+的红色溶液中加铁粉,振荡,颜色变浅或褪去。
⒑某有机物的分子式为C5H10O,它能发生银镜反应和加成反应,若将它们与H2加成,所得产物的结构简式可能是( )
A. 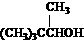 B.
(CH3CH2)2CHOH
B.
(CH3CH2)2CHOH
C. CH3(CH2)3CH2OH D. (CH3)2CHCH2CH2OH
⒒在一个固定体积的密闭容器中,加入2mol A和1mol B发生如下反应:2A(g)+B(g) 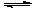 3C(g) +D(s),达到平衡时C的浓度为1.2mol/L。若维持容器体积和温度不变,按下列方法改变起始物质,达到平衡时C的浓度仍可能为1.2mol/L的是( )
3C(g) +D(s),达到平衡时C的浓度为1.2mol/L。若维持容器体积和温度不变,按下列方法改变起始物质,达到平衡时C的浓度仍可能为1.2mol/L的是( )
A. 4 mol A + 2 mol B
B. 3 mol C + 1 mol D + 1mol B
C. 3 mol C + 0.8 mol D
D. 1.6 mol A + 0.8 mol B + 0.6mol C + 0.3mol D
⒓下列各组热化学方程式中,化学反应的△H前者大于后者的是( )
① C(s) + O2(g)
= CO2(g); C(s)
+  O2(g) =
CO (g);
O2(g) =
CO (g);
② S(s) + O2(g) = SO2(g); S(g) + O2(g) = SO2 (g);
③ H2(g) +  O2(g) = H2O (g); 2H2(g)
+ O2(g)
= 2H2O
(l);
O2(g) = H2O (g); 2H2(g)
+ O2(g)
= 2H2O
(l);
④ CaCO3(s)= CO2(g) + CaO(s); CaO(s) + H2O (l) = Ca(OH)2 (s);
A. ① B. ③④ C. ②③④ D. ①②③
⒔莽草酸(结构简式为 )是一种抗禽流感病毒的成分,下列关于莽草酸的说法,正确的是( )
)是一种抗禽流感病毒的成分,下列关于莽草酸的说法,正确的是( )
A. 遇FeCl3溶液呈紫色 B. 能与Br2发生加成反应
C. 能发生酯化反应 D. 能与Br2发生取代反应生成白色沉淀
⒕某温度下,密闭容器中发生反应 a X (g) 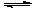 b Y (g) + c Z (g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是( )
b Y (g) + c Z (g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是( )
A. 可逆反应的化学计量数:a>b+c
B. 压缩容器的容积时,υ正增大,υ逆减小
C. 达到新平衡时,物质X的转化率减小
D. 达到新平衡时,混合物中Z的质量分数增大
⒖1-溴丙烷和2-溴丙烷分别与NaOH乙醇溶液共热的反应( )
A. 产物相同 B. 产物不同
C. 碳氢键断裂的位置相同 D. 碳氢键断裂的位置不同
第Ⅱ卷(非选择题,共46分)
⒗(每空2分,共12分。)
某化学反应 2A(g)  B(g) +D(g) 在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度随反应时间的变化情况如下表:
B(g) +D(g) 在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度随反应时间的变化情况如下表:
|
实验 序号 |
 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
1 |
800 |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
800 |
C2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
3 |
800 |
C3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
4 |
820 |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:(实验序号1以⑴代表,余同。)
①在⑴中,反应在10至20 min 内平均速率υ 为 mol·L-1·min-1;
②在⑵中,A的初始浓度c2 = mol·L-1。
③设⑶的反应速率为υ3,⑴的反应速率为υ1,则υ3 υ1(填>、=、<)且c3 1.0 mol·L-1(填>、=、<)。
④比较⑷和⑴,可推测该反应是 反应(选填“吸热”、“放热”)。理由是
。
⒘(每空2分,共4分。)
⑴发射“神州六号”载人飞船的长征火箭是用肼(N2H4)燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气。已知:
N2(g) + 2O2(g) = 2NO2(g) △H=67.7 kJ·mol-1;
N2H4(g) + O2(g) = N2(g) + 2H2O (g) △H=-534 kJ·mol-1;
肼与二氧化氮反应的热化学方程式为 。
⑵已知下列反应:
H2(g) = 2H(g) △H1=+Q1 kJ·mol-1;
O2(g) = 2O(g) △H2=+Q2 kJ·mol-1;
2H(g) +O(g) = H2O (g) △H3=-Q3 kJ·mol-1;
H2O (g) = H2O (l) △H4=-Q4 kJ·mol-1;
H2(g)
+  O2(g) = H2O (l) △H5=-Q5 kJ·mol-1;
O2(g) = H2O (l) △H5=-Q5 kJ·mol-1;
试指出Q1、Q2、Q3、Q4、Q5的等量关系: 。
⒙(每空2分,共6分。)
⑴设计实验证明溴乙烷在NaOH水溶液中发生取代反应(即溴乙烷里的Br变成了Br―)
。
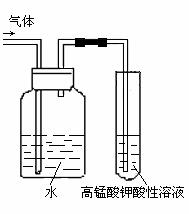 ⑵将溴乙烷与NaOH乙醇溶液的反应生成的气体进行
⑵将溴乙烷与NaOH乙醇溶液的反应生成的气体进行
检验。有人设计了如图实验方案。请回答:
气体通入KMnO4酸性溶液前加一个盛有水的洗气瓶,
其中洗气瓶中水的作用是 ,
其原因是
。
 ⒚(每空2分,共10分。)
⒚(每空2分,共10分。)
一密闭容器中发生下列反应
N2+3H2 2NH3;△H<0,
2NH3;△H<0,
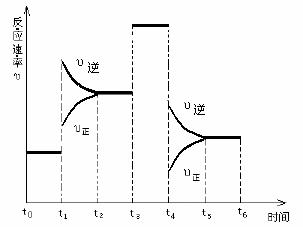
右图是某一时间段中反应速率与
反应进程的曲线关系图。回答:
⑴处于平衡状态的时间段是 。
⑵t1、t3、t4时刻,体系中分别是什么条件发生了什么变化?
、
、
。
⑶下列时间段中,氨的百分含量最高的是
A. t0-t1 B. t2-t3 C. t3-t4 D. t5-t6
⒛(每空2分,共16分。)
A是一种可以作为药物的有机物。请根据下图所示的转化关系,回答问题
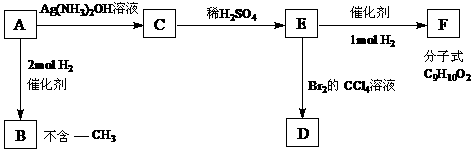
⑴写出A、B、F的结构简式:A B F
⑵写出下列变化的化学方程式,并注明反应类型。
A → C
反应类型
E → D
反应类型
⑶B的一种同分异构体只含一个-CH3,且1mol该物质能与浓Br2水反应,共消耗3mol Br2。则该有机物的结构简式为 。
第一学期期终教学质量检测
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com