
题目列表(包括答案和解析)
29.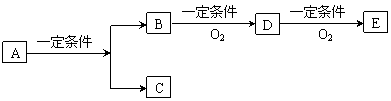 (10分)有下列转化关系:
(10分)有下列转化关系:
(1)若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时增加氧的质量约是D物质的总质量的25.8%,则A是_______________。
(2)若E是酸肝,且为易挥发的晶体,则A是____________,D转化为E的条件是______________________。(用化学式表示)
(3)若C是水,B是无氧化合物,且在同系物中分子量最小的化合物,E能使紫色石蕊显红色,则A是_____________________;A、B、D、E中易溶于C的是_______________。(用化学式表示)
28.某无色溶液,其中可能存在Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32-、
SO42-;取该溶液进行有关实验,实验结果如图所示:

请回答下列问题:
(1)生成沉淀甲的离子方程式为__________________________________;
(2)由溶液甲生成沉淀乙的离子方程式为______________________________;
(3)沉淀丙可能是_______________________,如何用化学实验确定其成份____________________________________________________________;
(4)综合上述信息,该溶液中肯定存在的离子有___________________________.
27.(1)在纯碱溶液中滴入酚酞,溶液变红,若在该溶液中再滴入过量的氯化钡溶液,所观察到的现象是_________________,其原因是(以离子方程式和简要的文字说明)___________________________________________________________________。
(2)在同温同压下,测得三种弱酸不同浓度时的电离度,列表如下:
|
酸 |
HA |
HB |
HC |
|||
|
物质的量浓度(mol/L) |
0.1 |
0.15 |
1 |
1.5 |
1 |
2 |
|
电离度 |
0.2% |
0.1% |
0.2% |
0.1% |
10% |
6% |
根据以上数据判断,三种酸由强到弱的顺序是_________________.
(3)重水的离子积c(D+) c(OD-)为1.6×10-15,可以用pH一样的定义来规定pD=-lgc(D+)。在100 mL 0.25 mol/L的DCl的重水溶液中加入50 mL 0.2 mol/L的NaOD的重水溶液(不考虑混合后体积变化),混合溶液的pD为_____________。
26.反应CaCO3 CaO+CO2在不同温度下,CO2的平衡压强如下表:
CaO+CO2在不同温度下,CO2的平衡压强如下表:
|
温度/℃ |
550 |
650 |
750 |
850 |
897 |
|
压强/Pa |
5.32×10 |
9.17×102 |
8.37×103 |
4.34×104 |
1.01×105 |
根据上表数据,填写下列空白:
(1)若升高原CaCO3分解平衡体系的温度,同时给反应容器加压,则原平衡__________.
A.向逆反应方向移动 B.向正反应方向移动
C.不移动 D.无法确定平衡移动方向
(2)在一个不与外界进行热交换的密闭容器中,足量的CaCO3在850℃时建立分解平衡。若将该容器的容积扩大原来的2倍,需重新达到平衡时,容器内的温度将_____________,CaCO3的分解率是_________,CO2的平衡压强将_________4.34×104Pa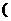 填>、=或<
填>、=或<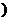 ,其理由是_____________________________________________________________。
,其理由是_____________________________________________________________。
25.工业上用氨和二氧化碳反应合成尿素:2NH3+CO2===CO( NH2)2+H2O,已知下列物质在一定条件下均能与水反应产生H2和CO2,H2是合成氨的原料,CO2供合成尿素用.若从充分利用原料的角度考虑,为了使H2与CO2的物质的量之比接近3∶1,最好选用( )
A.石脑油(C5H12、C6H14) B.CH4
C.CO D.碳
24.常温下跟镁粉、溴水、臭氧、硝酸都能发生氧化还原反应的是( )
A.H2S溶液 B.K2SO4溶液 C.NH4I溶液 D.NaOH溶液
23.鸦片具有复杂的组成,其中的罂粟碱的分子结构如下:
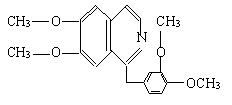
鸦片最早用于药物(有止痛、止泻、止咳作用),长期服用会成瘾,使人体质衰弱,精神颓废,寿命缩短.已知该物质的燃烧产物为CO2、H2O和N2,1 mol该化合物完全燃烧耗O2量及在一定条件下与Br2发生苯环取代反应生成的一溴代物同分异构体的种数分别是
( )
A.23.25 mol;5 B.24.5 mol;7
C.24.5 mol;8 D.26.5 mol;6
22.已知甲醛(HCHO)分子中4个原子是共平面的,下列分子中所有原子不可能同时存在于同一平面上的是( )
A.苯乙烯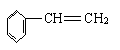 B.苯甲酸
B.苯甲酸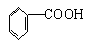
C.苯乙酮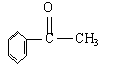 D.苯甲醛
D.苯甲醛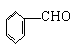
21.在一定温度下,向饱和的烧碱溶液中加入一定量的Na2O2,充分反应后,恢复到原来的温度,下列说法中正确的是( )
A.溶液的pH不变,有H2放出
B.溶液中的pH值增大,有O2放出
C.溶液中[Na+]增大,有O2放出
D.溶液中Na+数目减少,有O2放出
20.将0.1 mol/L的NH4NO3与0.05 mol/L NaOH溶液等体积混合后,溶液中各种微粒的物质的量浓度大小关系正确的是( )
A.c(Na+)=c(NH3·H2O)=c(NH4+)>c(OH-)
B.c(NH4+)>c(Na+)>c(NH3·H2O)>c(OH-)
C.c(Na+)=c(NH4+)>c(NH3·H2O)>c(OH-)
C.c(NH4+)>c(Na+)>c(OH-)>c(NH3·H2O)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com