
题目列表(包括答案和解析)
3.下列物质中属于非电解质,但放入水中后所得溶液导电性明显增强的是( )
A.金属钠 B.二氧化氮 C.氯化钠 D.乙醇
2.通常情况下,既能用浓硫酸干燥,又能用碱石灰干燥的是( )
A.NH3 B.Cl2 C.NO D.HCl
1.环境监测中心在公布城市空气质量周报时,无须公布的项目是 ( )
A.二氧化碳 B.固体悬浮物 C.二氧化硫 D.氮氧化物
26.(12分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应N2(g)+3H2(g)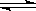 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,nt (N2) = 13mol,nt (NH3) = 6mol,计算a的值
(2)反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。 计算平衡时NH3的物质的量。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始)∶n(平) = 。
(4)原混合气体中,a∶b = 。
(5)达到平衡时,N2和H2的转化率之比, (N2)∶
(N2)∶ (H2)= 。
(H2)= 。
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3) = 。
25.(10分)设水的电离平衡曲线如图所示:
 (1)若以A点表示25℃时水的电离平衡时的离子浓度,当温度上升至100℃时,水的电离平衡状态到B点,则此时水的离子积从_____ ___变为_ _。
(1)若以A点表示25℃时水的电离平衡时的离子浓度,当温度上升至100℃时,水的电离平衡状态到B点,则此时水的离子积从_____ ___变为_ _。
(2)25℃把99.5mL0.2mol/LNaOH溶液加到100.5mL0.1mol/L硫酸中,计算所得溶液的pH 。
(3)100℃ 时,pH=8的Ba(OH)2溶液与pH=5的稀HCl混合,欲使混合液的pH=7,计算 Ba(OH)2与HCl的体积比
24.(10分)可逆反应3A(g) 3B(?)+C(?);△H<0
达到化学平衡后,升高温度。用“变大”、“变小”、“不变”或“无法确定”填空。
3B(?)+C(?);△H<0
达到化学平衡后,升高温度。用“变大”、“变小”、“不变”或“无法确定”填空。
⑴若B、C都是气体,气体的平均相对分子质量 ;
⑵若B、C都不是气体,气体的平均相对分子质量 ;
⑶若B是气体,C不是气体,气体的平均相对分子质量 ;
⑷若B不是气体,C是气体。
①如果A的摩尔质量大于C的摩尔质量,气体的平均相对分子质量 ;
②如果A的摩尔质量小于C的摩尔质量,气体的平均相对分子质量 。
23.(4分)一定条件下,A、B、C的起始浓度分别是a
mol/L、b
mol/L、c
mol/L,可逆反应A(g)
+B(g)  2C(g)达到平衡,测得c(A)=0.8mol/L、c(B)=0.5mol/L、c(C)=1.2mol/L。请回答:
2C(g)达到平衡,测得c(A)=0.8mol/L、c(B)=0.5mol/L、c(C)=1.2mol/L。请回答:
⑴a、b应满足的条件是_______ _______;
⑵a的取值范围是_____________。
22.(12分)有两个起始体积相同的密闭容器A和B,A容器有一个可移动的活塞,能使容器内保持恒压;B容器为固定体积。起始时这两个容器分别充入等量的体积比为2:1的SO2和O2的混合气,并使A、B容器中气体体积相等。在保持400℃条件下发生反应:2SO2
+ O2 2SO3,并达到平衡。
2SO3,并达到平衡。
⑴达到平衡所需时间A容器比B容器_______,两容器中SO2的转化率A比B_______ 。
⑵达到⑴所述平衡后,若向容器中通入数量不多的等量Ar气,A容器的化学平衡向___________移动,B容器的化学平衡______移动。
⑶达到⑴所述平衡后,若向容器中通入等量的原混合气体,重新达到平衡后,A容器中SO3的体积分数______,B容器中SO3的体积分数________
21.(6分)实验表明,液态时,纯硫酸的电离能力强于纯硝酸,纯硫酸的导电能力也强于纯水又知液态电解质都有能像水那样自身电离而建立电离平衡(即像2H2O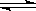 H30++OH-一样),且在一定温度下都有各自的离子积常数,由此回答:
H30++OH-一样),且在一定温度下都有各自的离子积常数,由此回答:
(1)纯硫酸在液态时,自身电离的电离方程式为: ,它在25℃时的离子积常数K(H2SO4)比1×10-14 (填“大”“小”或“相等”)
(2)在纯硫酸和纯硝酸的液态混合物中,存在的阴离子主要是 ;
20.(8分)钾是一种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:Na(l)+KCl(l)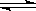 NaCl(l)+K(g)△H>0;
NaCl(l)+K(g)△H>0;
该反应的平衡常数可表示为:K==c(K),各物质的沸点与压强的关系见下表
|
压强/kPa |
13.33 |
53.32 |
101.3 |
|
K的沸点/℃ |
590 |
710 |
770 |
|
Na的沸点/℃ |
700 |
830 |
890 |
|
KCl的沸点/℃ |
|
|
1437 |
|
NaCl的沸点/℃ |
|
|
1465 |
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为 ,而反应的最高温度应低于 。
(2)在制取钾的过程中,为了提高原料的转化率可以采取的措施是 。
(3)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为:K= 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com