
题目列表(包括答案和解析)
23.(10分)化学纤维是传统三大合成高分子材料之一,其中的涤纶和维尼纶至今仍在纺织业中作为重要的原料。涤纶、维尼纶的结构简式如下:
涤纶:
(分子链两端连接的H-、-O-CH2-CH2-OH是链的终止基团)
维尼纶: (链的终止基团已被省略)
(链的终止基团已被省略)
工业上用煤、石油等综合利用的产物生产涤纶和维尼纶。下面是合成所需基本原料的制备方法。
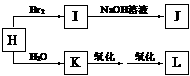

已知:A为单质,B、C、E、G、H通常情况下为气体。合成流程如下:
合成涤纶:
合成维尼纶:
回答下列问题:
⑴G与L反应生成N的反应类型是________ ;
⑵合成涤纶的流程中,可以重复利用的物质的名称是______________ 。
⑶高分子化合物O (填“能”或“不能”)能溶于水,原因是_________________________;
⑷写出M和J反应生成涤纶的化学方程式(涤纶的结构中应含有终止基团):
____________ ;
⑸写出O与E反应生成维尼纶的化学方程式:
________________________________________ 。
22.(8分)完全燃烧某一类有机物,只生成CO2和H2O,消耗氧气与所生成二氧化碳的物质的量相等。
⑴此类有机物满足的通式是 。(填序号)
①(CHx)m(H2O)n ②(COx)m(H2O)n ③Cm(H2O)n
⑵此类有机物中式量最小的A是______________。(填化学式)
⑶符合题示条件的物质B有多种,分子中均含有1个苯环,均含有16个原子。
①苯环上只有一个取代基,有杀菌、漂白作用的是________________。(写结构简式)
②不能水解,能还原银氨溶液,并能与FeCl3溶液发生显色反应的物质共有_________种。
21.(10分)化学几乎渗透于所有的行业,在考古工作中,化学就起着不可替代的作用。
⑴古墓中,石灰岩(主要成分CaCO3)上绘制的壁画在潮湿的条件下往往覆盖了一层白色薄膜,经测定为CaCO3,用化学反应方程式表示生成CaCO3的过程:
___________________________________________________________________________________。
⑵古画颜料中的铅白[Pb2(OH)2CO3]由于受空气中硫化氢气体的作用而变成溶解度极小的黑色硫化铅(反应Ⅰ),影响画面的色泽,当用过氧化氢处理后,可使硫化铅变成白色的物质(反应Ⅱ)。椐此回答下列问题:
①铅白的物质类型是______________。
②反应Ⅱ中生成的白色物质的化学式为____________ 。
③反应Ⅰ的化学反应方程式是______________________________________ 。
⑶古代铁器(埋藏在地下)在严重缺氧的环境中,仍然锈蚀严重(电化腐蚀)。原因是一种叫做硫酸盐还原菌的细菌,能提供正极反应的催化剂,可将土壤中的SO42-还原为S2-,该反应放出的能量供给细菌生长、繁殖之需。
① 写出该电化腐蚀的正极反应的电极反应式:______________________________________。
②文物出土前,铁器表面的腐蚀产物可能有(写化学式)_____________________________。
20. (8分)已知A是由两种中学常见元素组成的化合物,H、D为白色沉淀,E的焰色反应为黄色。A~H各物质之间的关系如图(反应中部分产物已略去,除气体间的反应外,其余反应均在溶液中进行)。
(8分)已知A是由两种中学常见元素组成的化合物,H、D为白色沉淀,E的焰色反应为黄色。A~H各物质之间的关系如图(反应中部分产物已略去,除气体间的反应外,其余反应均在溶液中进行)。
⑴X的化学式为________________;
⑵写出反应①、②的离子方程式:
① 。
② 。
⑶用电子式表示G的形成过程:
_________________________________________ 。
19.(10分)分子(或离子)的空间构型有直线形、角形、平面形、四面体形、三角锥形等。为了解释和预测分子的空间构型,科学家在归纳了已知分子的空间构型的基础上,提出一种简单的理论模型,其理论依据是:分子中的价电子对(包括成键电子对和孤对电子)由于相互排斥作用,而取向彼此远离以减小斥力,分子尽可能采取对称的空间构型。对于ABm形分子(A为中心原子,B为配位原子),分子中的价电子对数(n)可以通过下式确定:
n=
|
分子构型 |
AB2 |
AB3 |
AB2 |
AB3 |
AB4 |
|
价电子对数 |
2 |
3 |
4 |
4 |
4 |
|
几何构型 |
直线形 |
平面形 |
角形 |
三角锥形 |
四面体形 |
说明:①作为配位原子,氧原子、硫原子按不提供价电子计算;
②直线形分子中最少有3个原子,平面形分子中最少有4个原子。
(1) 指出下面物质分子或离子的空间构型:
PO43-______________ ;CS2_______________ ;AlBr3(共价分子)_______________ 。
(2)有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式:
 ________________;
________________; ___________________。
___________________。
(3)按要求写出第二周期非金属元素构成的中性分子的化学式:
平面形分子____________,三角锥形分子____________,四面体形分子_____________。
18. (12分)定量化学实验的设计除了要遵循化学实验一般原则外,预计并防止影响测定(测量)精确度的各种情况,显得尤为重要。
(12分)定量化学实验的设计除了要遵循化学实验一般原则外,预计并防止影响测定(测量)精确度的各种情况,显得尤为重要。
为了测定金属镁的相对原子质量,有人设计了如右图的装置。用托盘天平称出装置的总质量(包括足量的稀盐酸)为ag,将质量为bg的金属镁样品放入稀盐酸中,立即塞紧瓶塞。完全反应后称出装置的总质量为cg,从而计算出镁的相对原子质量。
⑴镁的相对原子质量的表达式为: 。
⑵实验中无水CaCl2的作用是:___________________________ 。
⑶测定结果证明,误差大得不能使人接受。实验中产生了很大的误差的主要原因是:
。
⑷又有人吸取了上面实验设计的经验,利用下面的仪器(仪器的组合),组装成一套装置,并顺利地完成了测定:

①应选用Ⅰ组中的________(填字母,下同)和Ⅱ组中的________相连接(导管的体积忽略)。选用Ⅰ组中的仪器的理由是__________________________________________________。
②此人不再测定气体的质量而改为测定气体的体积,其原因是_________________________。
③应根据装置的具体情况来确定称取多少金属镁。受仪器容积的限制,镁不能取用过多, 但也不能过少,镁不能取用过少的原因是________________________________________。
17. (10分)
(10分)
⑴ 和 的一些物理性质如下表:
|
物 质 |
熔 点 |
沸 点 |
密 度 |
水溶性 |
 |
-10℃ |
212℃ |
1.1622g/mL |
不溶于水 |
|
|
54℃ |
238℃ |
1.1581g/mL |
不溶于水 |
①分离这两种物质混合物可采用的方法是_______________。(填序号)
A.过滤 B.分液 C.蒸发 D.分馏
②实验需要用到的主要玻璃仪器是_________________________________________________。
⑵收集NH3气体可选用下图(Ⅰ)中的____________。(填序号,下同)
氯气的尾气吸收可用图(Ⅱ)中的______________。

(Ⅰ) (Ⅱ)
16.0.1mol·L-1NH4HSO4溶液与0.1mol·L-1NaOH溶液等体积混合,混合后溶液中浓度关系表
述正确的是
A.c(Na+)=c(SO42-)=c(H+)>c(NH4+)
B.c(Na+)>c(NH4+)>c(H+)>c(OH-)
C.c(Na+) + c(H+) + c(NH4+)=c(SO42-) + c(OH-)
D.c(H+)=c(OH-) + c(NH3·H2O)
第Ⅱ卷 非选择题(共86分)
15.一定量的铜与一定量的浓硝酸恰好完全反应,产生NO、NO2两种气体,已知反应中被还原的HNO3占HNO3总量的1/3,则还原产物中NO、NO2的物质的量之比为
A.1∶1 B.1∶2 C.2∶3 D.2∶1
14.常温下,甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,对下列叙述的判断正确的是
A.甲中水电离出来的H+的物质的量浓度是乙中水电离出来的H+的物质的量浓度的10倍
B.物质的量浓度c(甲)>10c(乙)
C.中和等物质的量的NaOH溶液需甲、乙两杯醋酸溶液的体积,10V(甲)>V(乙)
D.甲中的c(OH-)为乙中的c(OH-)的10倍
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com