
题目列表(包括答案和解析)
25、在250C,已知pH=2的高碘酸溶液与pH=12的NaOH溶液等体积混合,所得混合液显酸性;0.01mol·L-1的碘酸(HIO3)或高锰酸(HMnO4)溶液与pH=12的NaOH溶液等体积混合,所得混合液显中性。则高碘酸是 ;高锰酸是 (填“强酸”或“弱酸”),理由是
24、恒温、恒压下,在一个容积可变的容器中发生如下反应:
N2+3H2  2NH3
2NH3
(1)若开始时放入1mol N2和3 molH2,达到平衡后,生成amol NH3,这时N2的体积分数为 。
(2)若开始时放入 N2、6 molH2和2 molNH3,达到平衡后,N2和NH3的物质的量分别为
N2、6 molH2和2 molNH3,达到平衡后,N2和NH3的物质的量分别为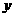 mol和3 amol,则
mol和3 amol,则 =
,
=
,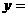 。平衡时H2的物质的量是 (选填一个编号)。
。平衡时H2的物质的量是 (选填一个编号)。
A.大于6 mol B.等于6 mol
C.小于6 mol D.可能大于、小于或等于6 mol
作出判断的理由是 。
(3)若在(2)的平衡混合物中,再加入6 molNH3,再次达到平衡后,NH3的质量分数为 。
23、某化工厂生产中要用到一种无色、可溶于水的晶体--铝铵矾,该晶体是一种复盐,其主要化学成分是硫酸铝铵--NH4Al(SO4)2,向该盐的浓溶液中加入浓KOH溶液,将发生一系列变化,已知NH4+和AlO2-不能大量共存,会发生反应:
NH4++ AlO2-+H2O==Al(OH)3↓+NH3,试求:
A.硫酸铝铵在水中电离的方程式:
B.在逐渐加入浓KOH溶液的过程中,产生的现象依次是:①溶液中出现白色沉淀,白色沉淀量逐渐增多 ②有刺激性气味的气体放出 ③白色沉淀量逐渐减少,白色沉淀完全消失,请依次写出滴入KOH溶液过程中发生的化学反应的离子方程式:
① ②
③
22、在25℃时,1mol·L-1的①(NH4)2SO4 ②(NH4)2CO3 ③(NH4)2Fe(SO4)2 ④NH4HSO4 ⑤NH4Cl的溶液中,c(NH4+)由大到小的顺序为
21、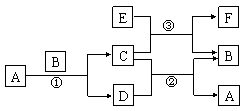 下图中所涉及的A、B、C、D、E、F和G等都是中学化学教材中常见的物质。反应①②是置换反应,反应①②③均在高温下进行。A在常温下为液态,C有磁性,F既能溶于NaOH又能溶于HCl。
下图中所涉及的A、B、C、D、E、F和G等都是中学化学教材中常见的物质。反应①②是置换反应,反应①②③均在高温下进行。A在常温下为液态,C有磁性,F既能溶于NaOH又能溶于HCl。
⑴A的电子式
⑵写出反应①的化学方程式
⑶写出E与浓强碱液反应的离子方程式
⑷C、E的混合物在工业上用钢轨焊接,写出反应③的化学方程式:
20、用中和滴定法测定某烧碱的纯度。
⑴配制待测液:将1.7g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200mL溶液,所用的主要仪器有________________________________________。
⑵滴定:①盛装0.20mol/L盐酸标准液应该用_______式滴定管,滴定管洗涤干净的标准是________________________________________________________________________。
②滴定时,应先向锥形瓶中加酚酞作为指示剂;滴定过程中两眼应该注视__________________,滴定终点时,锥形瓶中的溶液的颜色变化是(选序号)_________。
A、由黄色变为红色 B、由黄色变为橙色 C、由浅红色变为无色 D、由无色变为红色
③有关数据记录如下:
|
滴定序号 |
待测液体积(ml) |
所消耗盐酸标准液的体积(ml) |
|
|
滴定前 |
滴定后 |
||
|
1 |
20.00 |
0.50 |
20.70 |
|
2 |
20.00 |
6.00 |
26.00 |
⑶纯度计算:
NaOH溶液的浓度为______________mol/L,烧碱样品的纯度为____________。
⑷对几种假定情况的讨论:(填无影响、偏高、偏低)
①若用蒸馏水冲洗锥形瓶,则会使测定的结果_________________。
②若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果_________。
③若刚见到指示剂局部的颜色有变化就停止滴定,则会使测定结果_________。
④读数时,若滴定前仰视,滴定后俯视,则会使测定结果_________________。
19、弱电解质的电离存在着电离平衡,当达到电离平衡时,已电离的分子数占弱电解质总分子数的百分比称为电离度。在25℃时,pH=4的盐酸和氯化铵溶液中,水的离子积(Kw)和电离度(HCl和NH4Cl分别用αA和αB表示)的叙述正确的是
A、Kw相等,αB ==αA B、Kw不等,αB ==11αA
C、Kw相等,αB ==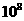 αA D、Kw相等,αB ==
αA D、Kw相等,αB ==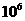 αA
αA
18、在容积一定的密闭容器中,可逆反应A2(g)+ B2(g)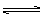 xC(g) 符合下列图Ⅰ所示关系,由此推断对图Ⅱ的正确说法是
xC(g) 符合下列图Ⅰ所示关系,由此推断对图Ⅱ的正确说法是

A.P3<P4,Y轴表示A2的转化率
B.P3<P4,Y轴表示A2的浓度
C.P3>P4,Y轴表示混合气体的密度
D.P3>P4,Y轴表示混合气体的平均摩尔质量
17、下列各溶液中,微粒的物质的量浓度关系正确的是:
A.0.1 mol/L的(NH4)2SO4溶液中:c (SO42– ) > c (NH4+ ) > c (H+)> c (OH–)
B.0.2 mo1/L的Na2CO3溶液中:c (OH–)= c (HCO3–) + c (H+) + 2 c (H2CO3)
C.0.1 mol/L的NH4Cl溶液与0.05 mol/L的NaOH溶液等体积混合:
C (Cl–) > c (Na+ ) > c (NH4+ ) > c (OH–) > c (H+)
D.c (NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液以及(NH4)2Fe(SO4)2溶液:
C[(NH4)2Fe(SO4)2]< c [(NH4)2SO4] < c [(NH4)2CO3]
16、有一铁的氧化物样品,用5 mol/L盐酸100 mL恰好完全溶解,所得溶液还能吸收标况下的氯气1.12 L,Fe2+全部被氧化为Fe3+,则该氧化物的化学式可表示为:
A.Fe2O3 B.Fe3O4 C.Fe4O5 D.Fe5O7
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com