
题目列表(包括答案和解析)
2、有机物种类繁多的原因:(1)碳的四键;(2)碳原子之间可以形成不同的共价键。如:C-C ;C==C;C≡C;苯环中的C~C键;(3)碳碳之间可以形成不同长度的碳链;(4)存在着同分异构现象。
思考:(1)自然界中含量最多的元素为_____,形成化合物种类最多的元素为____。
(2)比较键长的长短C-C 苯环中的C~C C==C C≡C
比较键能的大小 C-C 苯环中的C~C C==C C≡C
1、有机物的定义_______________________________________________________.
注意:(1)碳的氧化物如CO、CO2,以及碳酸、碳酸盐、碳酸氢盐、氰化物、硫氰化物等含碳化合物仍看成无机物。
(2)有机物一定是化合物,有机物中一定含有碳元素;无机物可能是化合物,也可能是单质,少量无机物中含有碳元素,单质碳属于无机物。
26. 苹果味饮料是一类由苹果发酵而成的酸性饮品,具有解毒、降脂等效果,其主要酸性物质为苹果酸。苹果酸在分离提纯后的化学分析如下:
①相对分子质量不超过150,完全燃烧后只生成CO2和H2O,分子中C、H的质量分数分别为35.82%和4.48%;②1mol该酸与足量的NaHCO3反应放出44.8LCO2,与足量的Na反应放出H2 33.6L(气体体积均为标况);③核磁检测,该分子中存在四种化学环境不同的碳原子,氢原子也处于五种不同的化学环境。
请回答:
(1)分子中有 个羧基,苹果酸分子式为 。
(2)苹果酸的结构简式为 。
(3)苹果酸的同分异构体中符合上述①、②两个条件的有 (写出任一种的结构简式)。
(4)该酸在一定条件下可以发生分子内脱水,(如该脱水的产物能使溴水褪色)其化学方程式为:_____________________________________,反应类型为_________
25.科学家致力于二氧化碳的“组合转化”技术的研究,把过多二氧化碳转化为有益于人类的物质。如果将CO2与H2以一定的体积比混合,在一定条件下发生反应,可获得重要的能源物质和水。
(1)标准状况下,将14LCO2和56LH2混合,通入反应器,在适当的条件下恰好完全反应,生成的气体可使碱石灰增重22.5克。则上述反应中可获得一种重要的能源物质是_____________
(2)调整CO2与H2混合时的体积比,可以得到不同的烃类。若将CO2和H2以1∶3的比例混合,使之发生反应生成某种重要的化工原料和水,该原料可能是( )
A.烷烃 B.烯烃 C.炔烃 D.芳香烃
(3)用CO2和H2可人工合成CnH2n+2的烷烃,写出该化学方程式并配平:
______________________ __________
(4)已知在443~473K时,用钴(Co)作催化剂可生成C5~C8的烷烃,这是人工合成汽油的方法之一。要达到该汽油的要求,CO2和H2的体积比的取值范围是多少?________________ __________
24.丙二酸二乙酯[CH2(COOC2H5)2]是有机合成的重要原料。下图是合成丙二酸二乙酯及由丙二酸二乙酯和苯甲醛合成肉桂酸的过程。回答下列问题:

(1)反应(Ⅰ)的反应类型是:______________________,
进行反应(Ⅱ)的适宜条件是____________________,
反应(Ⅲ)的另一种产物的化学式是______________。
(2)乙酸转化为氯乙酸的化学方程式是_____________________________________。
(3)丙二酸转化为丙二酸二乙酯的化学方程式是____________________________。
23.有机物甲的结构简式如下,它可通过不同的化学反应分别制得结构简式为乙-庚的物质.

请回答下列问题:
(1)指出反应的类型:
甲→丙:______________________,甲→丁:______________________.
(2)在甲-庚七种物质中,互为同分异构体的是______________________(填代号,多选扣分,下同);可看作酯类的是______________________.
(3)已知HCHO分子中所有原子都在同一平面内,则在上述分子中所有原子有可能都在同一平面内的物质是______________________.
22.有机物A与B无论以何种比例混合,只要总的物质的量一定,所得混合物中全部原子的核外电子总数即为定值。若A是分子中含有8个氢原子的烃,B是分子中含有3个碳原子的烃的含氧衍生物。请按要求填空:
(1)若A、B的相对分子质量相等,则A和B的分子式分别是
A:_____________,B_____________。
(2)若A、B的相对分子质量相差2,且B的分子中所有的H原子所处的化学环境完全相同,则A的分子式为_________ __,B的结构简式是__________________
21.1945年,美国学者E·G·Rochow在做普通电化学实验中发现:硅-铜合金与有机氯
化物反应生成一类新化合物二氯二甲基硅烷[(CH3)2SiCl2]和三氯甲基硅烷 (CH3SiCl3)。硅烷衍生物的性质和烷烃衍生物相似,但硅保持其在原硅酸中的结构特点。
⑴ 写出二氯二甲基硅烷在氢氧化钠水溶液中反应的化学方程式 ;
⑵ E·G·Rochow在实验中得到的是二氯二甲基硅烷和三氯甲基硅烷的混合物。分析这种混合物的方法如下:把已知质量的混合物密封在安瓿中并放入盛有过量NaOH溶液的厚壁锥形瓶,摇动锥形瓶使安瓿振碎,二氯二甲基硅烷和三氯甲基硅烷分别和NaOH反应。过量的NaOH用盐酸滴定。实验测得空安瓿的质量为4.621 g,安瓿和供分析用的混合物总质量为5.4515 g,加入浓度为0.926 0 mol/L 的NaOH溶液25.00 mL;滴定过量NaOH溶液用去浓度为0.5000 mol/L 的HCl溶液15.44 mL。则混合物中n[(CH3)2SiCl2]= ,n (CH3SiCl3) =
{已知M[(CH3)2SiCl2]=129.0g/mol,M (CH3SiCl3) =149.5g/mol};
20.实验室可利用甲醇、空气、铜或氧化铜来制备甲醛,关于甲醇和甲醛的沸点和水溶性见下表:
|
|
沸点/℃ |
水溶性 |
|
甲醇 |
65 |
与水相溶 |
|
甲醛 |
-21 |
与水相溶 |
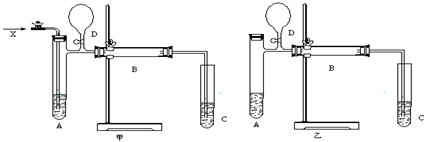 下图是甲、乙两位同学设计的实验装置,甲和乙的反应装置和收集装置相同,而气体发生装置不同,D处的气球均在反应结束时使用,分别如甲和乙所示。
下图是甲、乙两位同学设计的实验装置,甲和乙的反应装置和收集装置相同,而气体发生装置不同,D处的气球均在反应结束时使用,分别如甲和乙所示。
请回答:
(1)若按甲装置进行实验,则通入A试管的X是__________________,
B管中发生反应的化学方程式为__________________________ 。
(2)若按乙装置进行实验,则B管中应装入__________________,
B管中发生反应的化学方程式为__________________________。
(3)C试管中装入的试剂是____________,管内收集到的物质有__________。
(4)对甲、乙两装置中的A.B.C,还需要采取什么措施(实验室提供用品),才能使实验顺利进行?
对A是___ ____________,对B是____ _________,对C是______________
(5)反应结束时,先打开D处的活塞,然后_________________________
19.(1)下列实验操作或对实验事实的描述正确的是 (填序号)
①做银镜反应实验的试管在实验前用热碱液洗涤;
②水中含有少量苯和硝基苯,可用活性炭吸附除去;
③ 在试管中放入几片碎滤纸,滴几滴90%的浓硫酸,再将滤纸捣成糊状,微热并冷却后先滴入几滴CuSO4溶液再加入过量的NaOH溶液加热至沸腾,可观察到红色沉淀生成;
④ 蒸馏石油时,冷凝管中的冷水应上进下出;
⑤准确取用20.00mL的溴的四氯化碳溶液的方法是:取一支25mL的碱式滴定管,先用溴的四氯化碳溶液润洗,再加溶液至1.00mL处,用手挤玻璃球,放溶液至21.00mL处
⑥检验某溶液中含SO42-的操作与现象是:取试样少量,滴加氯化钡溶液有白色沉淀,再加入盐酸,沉淀不消失,可确证其中含有SO42-。
(2)无水乙酸又称冰醋酸(熔点16.6℃)。在室温较低时,无水乙酸就会凝结成像冰一样的晶体。请简单说明在实验中若遇到这种情况时,你将如何从试剂瓶中取出无水乙酸。
答:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com