
题目列表(包括答案和解析)
1、2、3、8、11、18、24(6’)、25(13’)
第二节 水的电离和溶液的酸碱性(共33分)
26.m(BaSO4) =46.6g c(NaHSO4)=4.2mol/L
试卷分析:(1~20题为选择题 3分/题)
第一节 弱电解质的电离(共37分)
25. Cl2 、 HClO 、 H2O 、 H+ 、 Cl- 、 ClO- OH- ;
NH3 、 H2O NH3·H2O NH4+ OH- H+。
24.促进电离;抑制电离;抑制电离;
21. ⑥①⑧⑤⑦④③②。 22. 15 。
23(1)Fe3+ + 3H2O 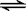 Fe(OH)3 + 3H+
Fe(OH)3 + 3H+
 CaCO3
+ 2H+ =Ca2+ +
H2O +CO2
CaCO3
+ 2H+ =Ca2+ +
H2O +CO2

 碳酸钙消耗H+ ,促进氯化铁的水解,使水解产物 Fe(OH)3大量生成,形成红褐色沉淀.(2).SiO32-+ 2NH4+ = 2NH3 + H2SiO3
碳酸钙消耗H+ ,促进氯化铁的水解,使水解产物 Fe(OH)3大量生成,形成红褐色沉淀.(2).SiO32-+ 2NH4+ = 2NH3 + H2SiO3
26.在100mL 2mol/L的Ba(OH)2溶液中滴加100mL NaHSO4溶液,测得溶液的pH为1,求产生的沉淀的质量,以及NaHSO4溶液的物质的量浓度。
|
25.(13分)用化学式和离子符号表示氯水和氨水中分别含有的微粒:
氯水: 、 、 、 、 、 、 ;
氨水: 、 、 、 、 、 ;
24.(6分)在氨水中存在如下平衡NH3·H2O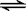 NH4+ + OH-,分别加入少量盐酸、NaOH溶液和NH4Cl溶液后,对NH3·H2O的电离平衡各有什么影响? (填 “促进电离”或 “抑制电离”或 “平衡不移动”)
NH4+ + OH-,分别加入少量盐酸、NaOH溶液和NH4Cl溶液后,对NH3·H2O的电离平衡各有什么影响? (填 “促进电离”或 “抑制电离”或 “平衡不移动”)
|
加入的物质 |
少量盐酸 |
少量NaOH 溶 液 |
少量NH4Cl 溶 液 |
|
对电离平衡的影响 |
|
|
|
23.(9分)(1)氯化铁水解的离子方程式为 ,向氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,并产生无色气体,其离子方程式为 。同时有红褐色沉淀生成,其原因是 。
(2)水玻璃在工业上可作粘合剂,它与NH4Cl溶液接触时,会很快凝结,用离子方程式表示其原因为 。
22.(3分) 10体积的盐酸和1体积的NaOH混合后,pH=7,则盐酸和NaOH的pH之和是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com