
题目列表(包括答案和解析)
14.次氯酸是比碳酸还弱的一种酸,当反应Cl2+H2O(l) 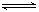 HCl(l)+HClO(l) 达平衡后,为了增大溶液中HClO的浓度,应采取的措施是
HCl(l)+HClO(l) 达平衡后,为了增大溶液中HClO的浓度,应采取的措施是
A. 加入CuCO3固体 B. 加入NaOH固体
C. 加水 D. 加压
13.在一定条件下,将1 mol CO和1 mol水蒸气混合后发生如下变化:
CO(g)+H2O(g)
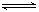 CO2(g)+H2(g)若反应达平衡时测得CO转化率为21.75%,则平衡混合气体的密度为相同条件下H2 密度的
CO2(g)+H2(g)若反应达平衡时测得CO转化率为21.75%,则平衡混合气体的密度为相同条件下H2 密度的
A. 5.75倍 B. 11.5倍 C. 30.67倍 D. 46倍
12.在一固定容积的密闭容器中充入1 mol N2和3 mol H2,在催化剂存在下建立如下平衡:
 N2+3H2 2NH3
N2+3H2 2NH3
测得平衡时H2的体积分数为 a%,在维持温度不变的条件下,再向上述平衡体系中充入1mol NH3,待新平衡建立后,测得H2的体积分数为b%,则a与b的关系为
A. a<b B. a=b C. a>b D. 无法判断
11.在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加入 a mol及b mol碘化氢(a>b),待反应2HI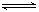 I2
(g)+H2(g)
达平衡后,下列说法肯定正确的是
I2
(g)+H2(g)
达平衡后,下列说法肯定正确的是
A. 从反应开始到建立平衡所需时间:tA<tB
B. 平衡时I2的浓度:c(I2)A = c(I2)B
C. 平衡时碘蒸气在混合气体中的百分含量:A容器中的大于B容器中的
D. 平衡时HI的分解率:αA = αB
10.密闭容器中进行的反应为
X(g)+3Y(g) 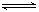 2Z(g),X、Y、Z 的起始浓度依次为0.1 mol / L,0.3 mol / L,0.2 mol / L,当反应达平衡时,各物质的浓度可能是
2Z(g),X、Y、Z 的起始浓度依次为0.1 mol / L,0.3 mol / L,0.2 mol / L,当反应达平衡时,各物质的浓度可能是
A. X=0.2 mol / L,Y=0.6 mol / L B. Y=0.5 mol / L或Y=0.1 mol / L
C. Y=0.3 mol / L D. Z=0.4 mol / L
9.在一个固定容积的密闭容器中,加入m mol A、n mol B发生下列反应:mA(g)+nB(g) 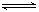 pC(g),平衡时C的浓度为W mol/L。若维持容器体积和温度不变,起始时放入a mol A、b mol B、c mol C,要使平衡后的浓度仍为W mol/L,则a、b、c必须满足的关系是
pC(g),平衡时C的浓度为W mol/L。若维持容器体积和温度不变,起始时放入a mol A、b mol B、c mol C,要使平衡后的浓度仍为W mol/L,则a、b、c必须满足的关系是
A. a∶b∶c=m∶n∶p
B. a∶b=m∶n; +c=p
+c=p
C.  +a=m;
+a=m;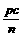 +b=n
D. a=
+b=n
D. a= ;b=
;b= ;c=
;c=
8.对于一可逆反应,当确知平衡向正反应方向移动,下列说法正确的是
A. 反应物的转化率将提高 B. 生成物的产量将增加
C. 生成物的浓度将增大 D. 生成物的百分含量将增大
7.在一定体积和一定条件下有反应N2+3H2 2NH3,现分别从两条途径建立平衡:I.起始浓度N2
1mol/L,H2 3mol/L,II.起始浓度N2
2mol/L,H2 6mol/L,下列叙述正确的是
2NH3,现分别从两条途径建立平衡:I.起始浓度N2
1mol/L,H2 3mol/L,II.起始浓度N2
2mol/L,H2 6mol/L,下列叙述正确的是
A.I和II两途径达到平衡时,体系内各成分的体积分数相同
B.达到平衡时,I途径的反应速率v(H2)等于II途径的反应速率v(H2)
C.达到平衡时,I途径体系内混合气体的密度为途径II的1/2
D.达平衡时,II途径体系内混合气体的压强是I途径的2倍
6.在容积为1 L的固定真空容器中,加入3.68 g N2O4无色晶体,升温至20℃,晶体逐渐气化成无色气体,并部分离解为红棕色的NO2气体,直至达到化学平衡:N2O4(g)
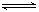 2N2O4(g)(正反应为吸热反应),从化学反应刚发生直到化学平衡的全过程中,以下量的变化正确的是(温度不变)
2N2O4(g)(正反应为吸热反应),从化学反应刚发生直到化学平衡的全过程中,以下量的变化正确的是(温度不变)
A. 气体总压强减小 B. 气体平均相对分子质量减小
C. 气体的密度增大 D. 气体的密度减小
5.将气体A2和B2等物质的量注入容积为1 L的密闭容器中反应生成C,平衡时测得c(A2)=0.58 mol/L,c(B2)=0.16 mol/L,c(C)=0.84 mol/L,则C的分子式为
A. AB B. A2B C. AB2 D.A2B3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com