
题目列表(包括答案和解析)
24.(8分)根据下列反应框图填空。已知A是一种重要的金属单质;反应①是工业上冶炼金属E的反应,反应②在实际生产中也有重要用途;F是一种红褐色的固体(部分反应物或产物已略去)。
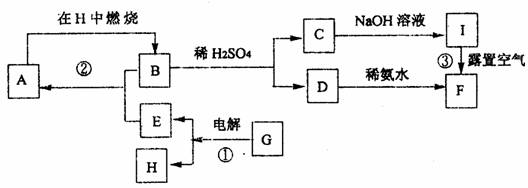 (1)单质A是
,化合物F是
(1)单质A是
,化合物F是
(2)写出反应①、②、③的化学方程式:
①
②
③
23.(8分)有两份无色透明的溶液,都能与Al反应放出氢气。已知每份溶液中含有较多量的下列8种离子中的阴阳离子各两种。这8种离子是:H+、K+、Mg2+、Na+、OH-、CO32-、SO42-、Cl-。
第一份溶液呈酸性,则含有较多量的四种离子是 ,
第二份溶液呈碱性,则含有较多量的四种离子是 。
22.(10分)在一密闭的容器中充入1molN2和3molH2,在一定条件下反应达到如下平衡:N2+3H2 2NH3
2NH3
(1)当温度和容积不变时,再充入0.25molNH3,压强将 (填增大或减小或不变),平衡向 方向移动(填正反应或逆反应)。
(2)当温度和压强不变时,再充入0.25molNH3,平衡时混合气体的体积将 (填增大或减小或不变)平衡混合气体中NH3的质量分数将 (填增大或减小或不变)。
(3)如果从逆反应方向建立与(1)(未充NH3时)相同的平衡体系,则开始时应向容器中投入 mol NH3。
21.(10分)如图所示,水槽中的试管内放置一枚不纯的铁钉,放置数天后观察现象。
(1)若试管内的液面上升,原溶液呈中性,则发生 腐蚀,电极反应式为:
正极: ,
负极: 。
(2)若试管内的液面下降,原溶液呈 性,则发生析氢腐蚀,电极反应式为:
正极:
负极:
20. (13分)实验室用稀硝酸与铜反应制备NO气体。如果采用(Ⅰ)装置,由于烧瓶内的空气不易排除,生成的NO很快被氧化成红棕色的NO2,不易观察到有无色的NO生成;即使用排水法收集到无色的NO,也会产生歧议。有人设计了(Ⅱ)装置,可达到满意的效果。
(13分)实验室用稀硝酸与铜反应制备NO气体。如果采用(Ⅰ)装置,由于烧瓶内的空气不易排除,生成的NO很快被氧化成红棕色的NO2,不易观察到有无色的NO生成;即使用排水法收集到无色的NO,也会产生歧议。有人设计了(Ⅱ)装置,可达到满意的效果。
(1)用(Ⅰ)装置实验,“即使用排水法收集到无色的NO,也会产生歧议,”其理由是
(2)将以(Ⅱ)装置进行实验的有关操作补充完全:
①将分液漏斗的活塞打开,从U形管的长管口注入稀硝酸,直至
为止。
②关闭分液漏斗活塞,用酒精灯在 处微热,当
时,立即撤去酒精灯。
(3)回答有关问题:
①反应在什么情况下即可自行停止?
可在何处观察到无色的NO气体?
②如果再将分液漏斗的活塞慢慢打开,可立即观察到哪些明显的现象?
其理由是
19.(9分)用已知浓度的盐酸滴定一定体积的氢氧化钠溶液,以测定NaOH溶液的物质的量浓度。
(1)准确量取一定体积的NaOH溶液,应选用 。滴定时,应 手
持握 。
(2)以酚酞作指示剂,当 时,即达滴定终点。
(3)下列操作可能使测定值较实际值偏低的是 (填序号)。
A.酸式滴定管未用标准HCl溶液润洗直接加入标准HCl溶液
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后未干燥
C.酸式滴定管尖嘴处在滴定前有气泡,滴定后气泡消失。
D.读标准HCl溶液体积时,滴定前仰视,滴定后俯视
18.将充有25mL O2和NO2的混合气体的试管,倒置在水槽中,反应完毕后,试管内残留气体为5mL,则原混合气体中NO2的体积是 ( )
A.16 mL B.19 mL C.23 mL D.2 mL
第Ⅱ卷(非选择题共78分)
17.下列离子方程式书写正确的是 ( )
A.四氧化三铁溶于足量的稀硝酸:Fe3O4+8H+ =Fe2++2Fe3++4H2O
B.明矾溶液中加入氢氧化钡溶液使SO42-刚好完全沉淀:
Al3++4OH-+2 Ba2++2SO42-=AlO2-+2BaSO4↓+2H2O
C.硫化钠溶于水中:S2-+2H2O = H2S↑+ OH-
D.三氯化铁溶液中滴加硫氰化钾溶液: Fe3++3SCN- = Fe(SCN)3↓
16.某金属硝酸盐受热分解生成金属氧化物、二氧化氮和氧气。若生成的二氧化氮和氧气的物质的量之比为8:1,则金属元素的化合价在反应过程中的变化是 ( )
A.升高 B.降低 C.不变 D.无法确定
15.在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加人质量不等的锌粒,尽应结束后得到等量的氢气。下列说法正确的是 ( )
A.甲烧杯中放入锌的质量比乙烧杯中放入锌的质量大
B.甲烧杯中的酸过量
C.两烧杯中参加反应的锌等量
D.反应开始后烧杯中的c(H+)始终比甲烧杯中的c(H+)小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com