
题目列表(包括答案和解析)
32、铁粉和氧化铁粉末的混合物共48.8克, 加入到700毫升的稀硫酸中, 恰好完全反应, 得到氢气2.24升(标准状况)向反应后的溶液中滴入NH4SCN溶液, 搅拌均匀, 溶液未见红色, 也没固体残留。求:
(1)混合物中铁和氧化铁的质量?16.8g, 32g
(2)原稀硫酸的物质的量浓度?1mol/L
31、把0.69g Na投入500mL 0.1 mol/L的AlCl3溶液中,有0.78g白色沉淀生成,再投入多少克Na可使沉淀恰好完全溶解。
解:设需要投入的总的钠为X摩,根据方程式有下列关系:
4Na~~~~~~4NaOH~~~~AlCl3
4 4 1
X 0.5×0.1
X=0.2mol
需要再加入的金属钠的质量为0.2mol×23g/mol---0.69g=3.91g
答:略
30.有A.B.C.D.E五种化合物,其中A.B.C.D是铝元素的化合物。F是一种气体,标况下对空气的相对密度为1.103。有下列反应.
A + NaOH → D + H2O B  A + H2O
A + H2O
C + NaOH(适量)→B + NaCl, E + H2O →NaOH + F。
则化学式分别为 A._Al2O3 B._Al(OH)3
C._AlCl3 D.__NaAO2_ E._Na2O2_
29.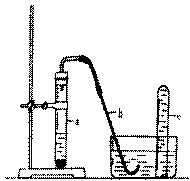 用右图的简易装置可以进行气体
用右图的简易装置可以进行气体
的发生和收集。
(1) 实验前应如何检查该装置的
气密性?
按图装配好把导管b放入水槽中,手握试管a观察导管b口是否有气泡产生,有气泡产生说明气密性良好
(2) 拔开试管 a的橡皮塞,加入10mL 6mol/L稀硝酸和1g薄铜片,立即将带有导管的橡皮塞塞紧试管口。反应开始时速度缓慢,逐渐加快,请写出在试管a中所发生的所有反应的化学方程式
3Cu+8HNO3 ==3Cu(NO3)2+2NO+4H2O
(3)在反应开始时,可观察到导管b中的水面先沿导管b慢慢上升到一定高度,此后又回落,然后有气泡从管口冒出。试说明反应开始时,导管中水面先上升的原因:
试管中有少量空气开始生成的NO与氧气反应生成了NO2,二氧化氮与水反应生成NO体积缩小所以导管中水会上升,反应一段时间后氧气反应完,生成的NO气体从导管中逸出
28.用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示。
|
实验编号 |
待测NaOH溶液的体积/mL |
HCl溶液的体积/mL |
|
1 |
25.00 |
24.40 |
|
2 |
25.00 |
24.38 |
|
3 |
25.00 |
24.42 |
试回答下列问题:
(1)使用酚酞做指示剂,滴定终点的判断是 加最后一滴盐酸溶液高为无变
(2)若滴定管没有用标准酸液润洗,测定的NaOH的浓度将_偏高__
(填偏高、偏低、不变。下同)
(3)读标准酸液初始读数体积时仰视,测定的NaOH的浓度将_偏低_
(4)根据以上数据,未知浓度的NaOH溶液的物质的量浓度是 0.1288
mol/L
27、某工厂为消除废气中的Cl2对环境的污染,将废气通过含有铁粉的FeCl2
溶液,即可有效地除去Cl2,问这一处理过程中最终消耗的原料是 Fe
写出反应离子方程式(1) 2 Fe2++Cl2==2Fe3++2Cl--
(2) 2Fe3++Fe═3Fe2+
26. 实验室快速制取多量氨气常用浓氨水加热。当氨水较稀(质量分数低于20%),并且不用加热的条件下,如采用向氨水中添加适当的固体氯化铵和烧碱的措施,仍能快速制取多量的氨气,简述理由
氯化铵与氢氧化钠反应生成氮,而烧碱溶解于水是放热的产生的氨气多 写出有关反应方程式 NH4Cl+NaOH═NH3.H2O +NaCl
25、在一定条件下,可逆反应xA+yB zC达到平衡。①已知A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z的关系是_____X+Y>Z___;②已知C是气体,并且x+y=z,在加压时化学平衡如发生移动,则平衡必定向__逆__方向移动;③已知B、C是气体,现增加A的物质的量(其它条件不变)平衡不移动,说明A是_固或液__态;④加热后,C的体积分数减小,则正反应是__放___热反应。
zC达到平衡。①已知A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z的关系是_____X+Y>Z___;②已知C是气体,并且x+y=z,在加压时化学平衡如发生移动,则平衡必定向__逆__方向移动;③已知B、C是气体,现增加A的物质的量(其它条件不变)平衡不移动,说明A是_固或液__态;④加热后,C的体积分数减小,则正反应是__放___热反应。
24. 金属钾与金属钠的金属性相近,且钾比钠略强。当利用金属钾与钠盐共熔制取金属钠时,发现钾与钠的共熔体难以分离。若调整温度到一定程度,则可用金属钠与氯化钾反应,制取金属钾。下面是四种物质的熔点和沸点:C
K Na KCl NaCl
熔点℃ 63.65 97.8 770 801
沸点℃ 774 882.9 1500(升华) 1413
根据化学平衡移动原理可推知,用钠与氯化钾反应制取金属钾的适宜温度是
A. 97.8~770℃ B.770~774℃
C.801~882.9℃ [i]D.1413~1500℃
22.在调整好的天平左右两盘中各放一只质量相等的烧杯,两烧杯中均盛有1mol/L的稀H2SO4 100mL,然后分别向烧杯中加入一定量的Mg和Al,充分反应后,天平仍保持平衡,则镁、铝的量分别为:( D )
A.2.4克Mg、1.8克Al B.2.4克Mg、2.7克Al
C.0.99克Mg、0.99克Al D.5克Mg、5克Al
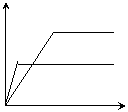
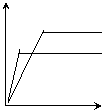 23对于可逆反应mA(固)+nB(气)
23对于可逆反应mA(固)+nB(气)  eC(气)+fD(气),当其它条件不变时,C的体积分数与T(温度)和p(压强)的关系曲线如下图所示:对此下列叙述中正确的是( BD ) c% c%
p1
eC(气)+fD(气),当其它条件不变时,C的体积分数与T(温度)和p(压强)的关系曲线如下图所示:对此下列叙述中正确的是( BD ) c% c%
p1
|
T2
t t
A若使用催化剂,C的平衡含量将增大
B.升高温度化学平衡向逆反应方向移动
C、 方程式中,n>e+f
D.A的颗粒越小,越有利于平衡向正反应方向移动
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com