
题目列表(包括答案和解析)
4.人体血液里Ca2+离子的浓度一般采用g/cm3表示.今抽一血样20.00ml,加过量的草酸铵[(NH4)2C2O4],溶液可析出草酸钙(CaC2O4)沉淀.将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用0.02mol/LKMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mlKMnO4溶液,试回答:
(1)滴定时,KMnO4溶液装在 滴定管中操作时,左手 ,右手 .
(2)草酸与KMnO4反应的离子方程式为:
5H2C2O4+2MnO4-+6H+=2Mnx++10CO2↑+8H2O
则式中x=
(3)滴定时,根据 现象,即可判断滴定终点.
(4)经过计算,血液样品中Ca2+的浓度为 g/cm3.
3.60年代美国化学家鲍林提出了一个经验规则:设含氧酸的化学式为HnROm其中(m-n)为非羟基氧原子数,鲍林认为含氧酸的强弱与非羟基氧原子数(m-n)有如下关系:
m-n 0 1 2 3
含氧酸强度 弱酸 中强 强 很强
实例 HClO H3PO4 HNO3 HClO4
试简要回答下列问题:
(1)按此规则H3AsO4、H2CrO4、HMnO4酸由强到弱的顺序为
(2)H3PO3和H3AsO4的形式一样,但酸的强弱相差很大已知H3PO4为中强酸,H3AsO4为弱酸,试推断H3PO3和H3AsO3的分子结构
(3)按此规则判断碳酸应属于 ,与通常认为的碳酸的强度是否一致? .其可能的原因
2.某盐的化学式为AxBOy,若A为+2价,B的化合价为 ,若此盐可完全电离,电离方程式为 ,若此盐为弱酸强碱盐,则水解离子方程式为(写第一步) .
1.二种钠盐,分别溶于水后,溶液PH均大于7,露置于空气中相当一段时间后(不考虑水分挥发),溶液的PH都近似为7,该两种溶液呈碱性的有关离子方程式为: ;
12.在Na2S溶液中存在着多种离子,下列关系正确的是( )
A.c(OH-)=c(HS-)+c(H+)+c(H2S) B.c(OH-)=2c(HS-)+c(H+)+c(H2S)
C.c(OH-)=c(HS-)+c(H+)+2c(H2S) a+)+c(H+)=2c(S2-)+c(HS-)+c(OH-)
11.在[OH-]=1×10-14mol/L的无色透明溶液中,因发生氧化-还原反应而不能大量共存的离子组为( )
A.NH+4
S2- 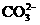 B.K+
B.K+  Cl-
Cl-
C.S2- 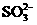 Na+ D.Ca2+
Na+ D.Ca2+ 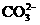 NO-3
NO-3
10.将PH=2的X酸溶液和PH=12的Y碱溶液等体积混合,溶液的PH不小于7,则X、Y分别依次为( )
A.强酸、强碱 B.强酸、弱碱
C.弱碱、弱酸 D.弱酸、强碱
9.有1支50ml的酸式滴定管,其中盛有0.1mol/L的盐酸溶液,液面恰好在15ml刻度处,若将试管内的酸溶全部放完刚好中和锥形瓶内35mlNaOH溶液,此碱液的物质的量浓度为( )
A.0.1mol/L B.小于0.1mol/L
C.大于0.1mol/L D.不能确定
8.物质的量浓度和体积均相同的下列各组物质的溶液混合后,PH大于7的是( )
A.NaCl、(NH4)2SO4、KNO3 B.Na2S、HCl、KCl
C.Ba(NO3)2、NH4Cl、Na2SO4 D.K2CO3、HNO3、HCl
7.0.1mol/L的醋酸溶液加水稀释或加入少量醋酸钠晶体时,发生变化相同的是( )
A.醋酸的电离程度增大 B.溶液的导电性减弱
C.溶液中c(H+)增大 D.溶液的PH增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com