
题目列表(包括答案和解析)
5.下列各物质加到或通入硝酸银溶液里能使溶液变浑浊的是( )
A.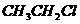
B.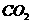
C.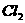
D.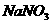
4.在卤代烃R-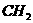 -
-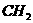 -X中化学键如下所示,则下列说法正确的是( )
-X中化学键如下所示,则下列说法正确的是( )
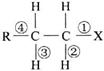
A.发生水解反应时,被破坏的键是①和③
B.发生消去反应时,被破坏的键是①和③
C.发生水解反应时,被破坏的键是①
D.发生消去反应时,被破坏的键是①和②
3.下列物质间的反应属于消去反应的是( )
A.浓硫酸和乙醇的混合液(3:1)加热至170℃
B.浓硫酸和苯的混和液加热至80℃
C.煮沸氯乙烷和苛性钾溶液
D.煮沸氯乙烷和苛性钾的醇溶液
2.分子式为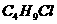 的有机物有( )
的有机物有( )
A.2种 B.3种 C.4种 D.5种
1.下列卤代烃能发生消去反应的有( )

26.(8分)环境监测中,测定水中溶解氧的方法是:
①量取a mL 水样迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好胶塞,并振荡摇匀,使之反应:2Mn2+ + O2 + 4OH- == 2MnO(OH)2
②测定:打开胶塞后迅速加入适量H2SO4(H+)使之反应:MnO(OH)2 +2I- +4H+== Mn2+ + I2 +3H2O
然后用bmol/L Na2S2O3溶液滴定(和I2反应),共消耗V mL(以淀粉为指示剂),其反应为:
I2 + 2 S2O32- == 2I- + S4O62-
试回答:
(1)以淀粉为指示剂,达到滴定终点,溶液由 色变 色。
(2)测定时,滴定管经水洗、蒸馏水洗后,加入滴定剂Na2S2O3溶液,导致测定结果 (选填偏高、偏低、无影响。)
(3)水中溶液氧(mg/L)计算式为 。
25.(7分)有铜和氧化铜的混合物8g,将其全部溶于 70mL 7mol/L+的硝酸中,反应后收集到3.36L(标准状况)气体;反应后用蒸馏水将溶液稀释至100mL,此时溶液的PH=0,从中取出10mL,跟10mL3.6mol/L的NaOH混合,求:
(1) 原混合物中铜和氧化铜的物质的量。
(2) 与NaOH溶液混合所得溶液的PH。(设混合后溶液体积为原两溶液体积之和)
24.(9分)一种澄清透明的溶液中,可能含有下列离子:K+、Fe3+、Ba2+、Al3+、NH4+、Cl-、、NO3-、HCO3-、SO42-,做了以下实验:
(1) 将溶液滴在蓝色石蕊试纸上,试纸呈红色;
(2) 取少量溶液,加入用稀HNO3酸化的BaCl2溶液,产生白色沉淀;
(3) 将(2)中的沉淀过滤,向滤液中加入AgNO3溶液,产生白色沉淀;
(4) 另取溶液,逐滴加入NaOH溶液至过量,只看到有红褐色沉淀生成,且沉淀质量不减少。由此可以推断:
溶液中肯定存在的离子有 ;溶液中肯定不存在的离子有 ;溶液中不能确定的离子有 。
23.(9分)用NH4Cl进行如下实验,判断发生的现象,并简单说明原因。
(1)用玻璃棒蘸取少量NH4Cl溶液与PH试纸接触时,试纸显示的颜色与标准比色卡对比,可发现NH4Cl溶液的PH 7,显 性,其原因用离子方程式表示
(2)向NH4Cl溶液中加入锌粒,可观察到有 生成,其主要成份是
(3) NH4Cl溶液中离子浓度从大到小的顺序是
22.(8分)已知25℃时0.1mol/L的CH3COOH溶液的PH约为3,向其中加入少量醋酸钠晶体,待晶体溶解后发现溶液的PH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c (OH-),因而溶液的PH增大;乙同学认为醋酸钠溶于水电离出的醋酸根离子,抑制了醋酸的电离,使c (H+)减小,因此溶液的PH增大。
(1)你认为上述两种解释中 (填甲或乙)正确
(2)为了验证上述哪种解释正确,继续做如下实验:向的醋酸溶液中加入少量下列物质中 (填写编号),然后测定溶液PH。
A.固体CH3COOK(水溶液显碱性) B. 固体CH3COONH4(水溶液呈中性)
C.气体NH3 D.NaHCO3(水溶液呈碱性)
(3)若 (填甲或乙)的解释正确,溶液的PH应 (填增大 、减小或不变)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com