
题目列表(包括答案和解析)
9.以下根据实验现象的推断,正确的是( )
A.能使湿润的碘化钾淀粉试纸变蓝的气体一定是氯气
B.在潮湿的空气中能形成白雾的气态氢化物一定是氯化氢
C.遇到空气能立即形成无色溶液的红棕色气体一定是二氧化氮
D.溶于水能形成无色溶液的红棕色气体一定是二氧化氮
8.自然界中氮的原子量为14.0037,则氮的两种同位素,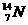 和
和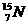 中
中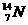 所占的物质的量的百分比为( )
所占的物质的量的百分比为( )
A.50% B.48.3% C.99.63% D.0.37%
7.大力推广使用无磷洗涤剂,是因为含磷、氮物质的大量使用,会造成湖泊的( )
A.鱼虾死亡
B.富营养化,产生“水华”现象
C.金属污染
D.氰化物污染
6.下列变化中不属于氮的固定的是( )
A.镁条在空气中燃烧生成氮化镁
B.雷雨闪电时,大气中产生了一氧化氮
C.豆科作物的根瘤菌使空气中的氮转化为氨
D.在一定条件下由氨气和二氧化碳合成尿素
5.能证明氮元素比磷元素非金属性强的事实是( )
A.NH3在空气中不能燃烧,而PH3在空气中能燃烧
B.氮气在常温下是气体,而磷单质是固体
C.氮气在空气中不能燃烧,磷在空气中可以燃烧
D.硝酸的酸性比磷酸强
4.下列关于红磷和白磷的说法中,错误的是( )
A.红磷和白磷在一定条件下可以相互转化
B.红磷和白磷都不溶于水,但都易溶于CS2
C.白磷无毒,而红磷有剧毒
D.白磷和红磷的着火点不同,但燃烧后都生成P2O5
3.在通常状况下,氮气的化学性质很不活泼,其原因是( )
A.氮气分子是双原子分子
B.氮原子的半径较小
C.氮分子中的N≡N键很牢固
D.氮元素有多种化合价
2.一种淡蓝色的蜡状物质,在空气中燃烧生成一种白色粉末X,将X溶于热水中生成含氧酸Y,若将X溶于冷水中,则生成含氧酸Z.则X为____________________,Y为____________________,Z为____________________.
1.氮族元素包括___________________、____________________、__________________、___________________、___________________5种元素,它们的原子最外电子层上的电子数是____________________.位于周期的____________________族.其最高价氧化物的通式是____________________,气态氢化物的通式为____________________,最高价氧化物对应水化物的通式是____________________.
3.将装有50mLNO2、NO混合气体的量筒倒立于水槽中,反应后气体体积缩小为30mL,则原混合气体中NO2和NO的体积比是( )
A.5∶3 B.3∶5 C.3∶2 D.2∶3
分析:判断此题可根据化学方程式,运用差量法进行计算,由所得结果来确定正确的选项.
解:设混合气体中NO2的体积为x
差量法:3NO2+H2O=2HNO3+NO △υ
3mL 1mL 3mL-1mL=2mL
x 50mL-30mL=20mL
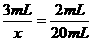
x=30mL
则窄混合气体中NO为50mL-30mL=20mL
所以:υ(NO2)∶υ(NO)=30∶20=3∶2
总结:差量法是根据化学反应中反应物和生成物的相差量跟反应物的消耗量或生成物的增加量之间的比例关系为解题思路而建立起来的解题方法.关键是找准变化量,把题中的已知差量与化学方程式中的化学计量数对应差量列出比例关系,进行计算,是一种简捷的解题方法.
解答本题除了用差量法外,还可以用列方程法求解.
解:设混合气体中NO2的体积为xmL,NO的体积为ymL.
根据反应方程式中NO2和NO的计量数之间的关系,可列出方程组:
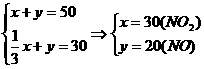
所以 υ(NO2)∶υ(NO)=3∶2
一题多解是训练思维提高能力的一种好方法.通过分析比较、启发思路,掌握多种解题方法,则可根据题目的特点,选用最简捷的方法解题,以提高学习效率.
对于NO2、NO混合气体跟水反应,或单纯NO2跟水反应的计算,均可根据反应方程式:3NO2+H2O=2HNO3+NO
应用差量法或列方程式进行计算.但要抓住化学计量数之间的关系.
典例精评:
例1 砷为第四周期第VA族,根据砷在周期表的位置推测,砷不可能具有的性质是:
A.砷在通常情况下是固体
B.As2O5对应水化物酸性比H3PO4强
C.可以有-3、+3、+5等多种化合价
D.AsH3比PH3稳定
解析:根据同主族元素性质递变性,酸性:H3PO4比H3AsO4强,稳定性PH3大于AsH3.故选 BD
例2 下列有关氮气元素的叙述中正确的是:
A.氮元素是活泼的非金属元素,因此N2的化学性质也很活泼.
B.NO2溶于水生成硝酸,所以NO2是硝酸的酸酐.
C.雷雨时,发生氮的固定变化可增加土壤中硝酸盐类氮肥的含量.
D.氮气可做古代书籍、文档、纸张的保护气.
解析:氮原子结构示意图为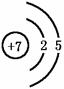 ,原子半径小,在化学反应中易得到3e或通过3个共用电子对而形成8电子稳定结构,所以氮元素是活泼的非金属元素;而氮分子的结构式为N≡N,N≡N键能大,因而分子的结构很稳定,在通常情况下,氮气的化学性质很不活泼.
,原子半径小,在化学反应中易得到3e或通过3个共用电子对而形成8电子稳定结构,所以氮元素是活泼的非金属元素;而氮分子的结构式为N≡N,N≡N键能大,因而分子的结构很稳定,在通常情况下,氮气的化学性质很不活泼.
B中NO2溶于水:3NO2+H2O=2HNO3+NO,发生了氧化-还原反应,氮元素的化合价发生了改变,所以NO2不是HNO3的酸酐.在HNO3中N为+5价,对应的氧化物N2O5才是酸酐.
C中,夏天雷雨时,由于天空闪电,激发了N2与O2的反应生成NO,即使N2生成NO.而NO幼易与空气中O2化合成NO2,NO2又溶于雨水中形成HNO3.整个过程符合氮的固定概念,由于雨水中含有一定量的HNO3,所以增加了土壤中氮肥的含量.
D中,由于N2的化学性质不活泼,很难与周围物质发生反应,所以可以用来做古代书籍、文物的保护气.故选CD
例3 一定条件下,将等体积NO和O2的混合气体置于试管中,并将试管倒立于水槽中,充分反应后剩余气体的体积约为原总体积的 ( )
A.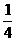 B.
B. 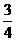 C.
C. 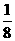 D.
D. 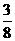
解析一:反应叠加法.此题涉及到反应2NO+O2=2NO2,3NO2+H2O=2HNO3+NO的多次循环,将这两个化学方程式叠加得4NO+3O2+2H2O=4HNO3
由此可知,等体积(设均为4体积)NO和O2的混合气体终了O2剩余,剩余O2的体积(为1体积)为原混合气体总体积的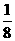 .故正确答案为C.
.故正确答案为C.
解析二:电子守恒法.
设NO和O2的物质的量均为nmoL,若nmoLNO完全转化为HNO3,将失去了3nmoL电子,若将nmoLO2完全转化为HNO3,将得到4nmoL电子,则O2有剩余.设剩余O2为x,则根据得失电子守恒原则得4(n-x)=3n,解得x=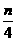 moL,从而得
moL,从而得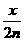 =
=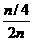 =
=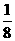 ,即剩余O2的体积为原总体积的1/8.故正确答案为C.
,即剩余O2的体积为原总体积的1/8.故正确答案为C.
解析三:组成比例法.
因生成HNO3的酸酐是N2O5,则氮的氮化物和O2与足量的水反应生成HNO3时,其中参加反应的氮原子与参加反应的非水氧原子数之比符合N2O5的组成,即N∶O=2∶5.而题目中给的NO和O2为等物质的量(设为n),则N∶O=n∶(n+2n)=1∶3,显然O2过量.
设剩余O2为x,则有n:[n+2(n-x)]=2∶5,解得x=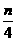 ,从而得到
,从而得到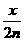 =
=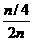 =
=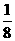 .故正确答案为C.
.故正确答案为C.
例4 取一根镁条置于坩埚内点燃,得到氧化镁和氮化镁混合物总质量为0.470g,冷却后加入足量水,将反应产物加热蒸干并灼烧,得到氧化镁质量为0.486g.
(1)写出氮化镁与水反应生成氢氧化镁和氨的化学方程式.
(2)计算燃烧所得混合物中氮化镁的质量分数.
解法一:设原混合物中MgO、Mg3N2的质量分别为x、y,则
Mg3N2+6H2O=3Mg(OH)2+2NH3
Mg3N2--3MgO(Mg守恒)
100 3×40
y 1.2y
根据题意: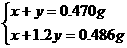
解得:y=0.080g W(Mg3N2)=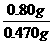 ×100%=17%
×100%=17%
解法二:设原混合物中Mg3N2的质量为x,则由差量法:
Mg3N2--3MgO △m增重
100 20
x (0.486g-0.470g)
x=0.080g W(Mg3N2)=17%
考点预测:
本节考点:①氮族元素性质的递变规律.②N2的重要性和固氮.③氮的氧化物(NO、NO2)的性质.④磷的同素异体的性质.
考查方式:①以元素、单质及化合物的性质以及相互转化关系为常考内容.②氮的氧化物与水的反应以及氮的氧化物与氧气的混合气体溶于水的有关计算.

[同步达纲练习]
基础知识强化练习:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com