
题目列表(包括答案和解析)
5、 目前人们正研究开发一种高能电池--钠硫电池,它以熔融的钠、硫为两极,以Na+导电的
目前人们正研究开发一种高能电池--钠硫电池,它以熔融的钠、硫为两极,以Na+导电的 ”-Al2O3陶瓷作固体电解质,反应如下:2Na + xS Na2Sx,以下说法正确的是
”-Al2O3陶瓷作固体电解质,反应如下:2Na + xS Na2Sx,以下说法正确的是
A.放电时钠作正极,硫作负极 B.放电时钠极发生还原反应
C.放电时钠作负极,硫作正极 D.放电时负极发生的反应是xS-2e = Sx2-
4、下列各组离子在强酸性、无色透明溶液中能大量共存的是( )
A、K+、Fe3+、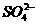 、Cu2+
B、K+、
、Cu2+
B、K+、 、
、 、Na+
、Na+
C、 、Al3+、
、Al3+、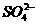 、NO3-
D、Fe3+、
、NO3-
D、Fe3+、 、Na+、S2-
、Na+、S2-
3、下列试剂不能使Fe2+转化为Fe3+的是
①氯气 ②硫化钠溶液 ③高锰酸钾溶液 ④稀硝酸 ⑤磷酸溶液 ⑥KSCN
A.①②③ B.①③④ C.④⑤⑥ D.②⑤⑥
2、下列关于铁的叙述错误的是
A.纯净的铁是光亮的银白色金属
B.铁能被磁体吸引,在磁场作用下,铁自身也能产生磁性
C.铁是地壳中含量最多的金属元素,所以分布在地壳中的铁有游离态也有化合态
D.纯铁的抗蚀能力相当强,铁在干燥的空气里不易被氧化
1、地壳中硅、氧、铁、铝四种元素的含量大小顺序正确的是
A.硅>氧>铝>铁 B.氧>硅>铝>铁 C.氧>硅>铁>铝 D.硅>氧>铁>铝
26.100ml0.6mol/LAlCl3溶液与一定量0.4mol/LNaOH溶液混合后,得到3.9克沉淀,求NaOH溶液的体积。
27在.1LFe2(SO4)3和CuSO4的混合液中,加入30克铁粉,最后得到1L0.5mol/L的FeSO4 溶液和26克固体沉淀物。求原溶液中含Fe2(SO4)3、CuSO4的物质的量。
第一学期高二期末考试
25.在100ml0.50mol/LH2SO4溶液中投入锌粒,锌完全反应后,还需用40ml0.5mol/LNaOH溶液才能完全中和,求锌粒的质量。
24.(9分)已知 在酸性条件下,发生还原反应后的产物为NO;发生氧化反应后的产物为
在酸性条件下,发生还原反应后的产物为NO;发生氧化反应后的产物为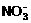 。现有稀H2SO4 、NaOH溶液、氨水、KMnO4溶液、KI淀粉溶液、NaNO2溶液等试剂。请用简捷、实验现象明显的方法来说明亚硝酸根既具有氧化性又有还原性。(已知MnO4-在酸性条件下遇还原剂可转变成Mn2+ )
。现有稀H2SO4 、NaOH溶液、氨水、KMnO4溶液、KI淀粉溶液、NaNO2溶液等试剂。请用简捷、实验现象明显的方法来说明亚硝酸根既具有氧化性又有还原性。(已知MnO4-在酸性条件下遇还原剂可转变成Mn2+ )
(1) 说明 具有氧化性,应选用的试剂有__________________;发生的现象是______________;反应的离子方程式为_____________________________________。
具有氧化性,应选用的试剂有__________________;发生的现象是______________;反应的离子方程式为_____________________________________。
(2) 说明 具有还原性,应选用的试剂有___________________________;发生的现象是______________;反应的离子方程式为_____________________________________。
具有还原性,应选用的试剂有___________________________;发生的现象是______________;反应的离子方程式为_____________________________________。
四 计算题(19分)
21.(2分)下面是某学生用已知浓度的盐酸溶液测定未知浓度的NaOH溶液的部分操作,其中错误的是 ( )
A. 取一锥形瓶,用待测NaOH溶液润洗两次后装入25 mL待测NaOH溶液
B. 加入几滴石蕊试液作指示剂
C. 取一支酸式滴定管,洗涤干净后直接往其中注入标准盐酸溶液
D. 滴定时,两眼注视滴定管内盐酸溶液液面下降,直至滴定终点
22(14分)用一种试剂鉴别NaCl MgCl2 AlCl3 NH4Cl FeCl2 CuCl2 ,这种试剂是 .鉴别的现象和反应的离子方程式是;
NaCl
MgCl2
AlCl3
NH4Cl
FeCl2
CuCl2
23(6分) 分别除去下列各物质中的杂质,在空白处写出所用试剂的化学式。
(1) 除去MgCl2中混有的少量MgCO3,可选用的试剂是
(2) 除去FeCl2中混有的少量Cu2+,可选用的试剂是
(3) 除去铁粉中混有的少量铝粉,可选用的试剂是
20. 在Na2S溶液中存在的下列关系正确的是 ( )
A. c(Na+)=c(S2-) B. c(Na+)∶c(S2-)=2∶1
C. c(Na+)∶c(S2-)>2∶1 D. c(Na+)∶c(S2-)<2∶1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com