
题目列表(包括答案和解析)
24.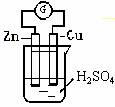 (6分)某学生进行如右图所示的锌-铜原电池实验:
(6分)某学生进行如右图所示的锌-铜原电池实验:
(1)从理论上分析,预期看到的现象是
(2)实验过程中观察到锌极上有少量气泡逸出,铜极上有大量气泡逸出,试解释: 。
(3)在实验室里用锌粒与稀硫酸反应制H2的过程中,若发现产生H2速率较慢,可向其中加入几滴 溶液。
(4)实验过程中,电流计指针偏向 极。
23.(6分)完成下列化学方程式,将化学计量数和未知物的化学式填在方格内;
Cu2S + HNO3 = Cu(NO3)2 + NO↑ + H2SO4 + .
(1)此反应中氧化剂是(填写化学式) ,被氧化的元素是 。
(2)若有22.4L(标准状况下)NO产生,则转移的电子数目为 。
22.将a mol钠和a mol铝同时投入到m g足量的水,所得溶液密度为d g/mL,该溶液中溶质的质量分数为 ( )
A.
 B.
B. 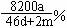 C.
C. 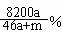 D.
D. 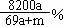
21.现有下列物质:①氯水 ②氨水 ③浓硝酸 ④氢氧化钠 ⑤溴,其中必须保存在棕色瓶中的是 ( )
A.全部 B. ①③⑤ C.①③ D.①②④
20.在室温下,等体积的下列酸和碱的溶液混合后pH一定小于7的是
A.pH=3的硝酸与pH=11的氢氧化钾
B. Ph=3的盐酸与pH=11的氨水
C. PH=3的硫酸与pH=11的氢氧化钠溶液
D.PH=3的醋酸与PH=11的氢氧化钡溶液
19.氢氧燃料电池是将H2和O2分别通入电池,穿过浸入20%-40%的KOH溶液的多孔碳电极,其电极反应式为:2OH-+H2-2e-=2H2O和1/2O2+H2O+2e-=2OH-,则下列叙述正确的是
A.通入H2的一极是正极,通入O2的一极是负极
B. 通入O2的一极是正极,通入H2的一极是负极
C. 工作一段时间后电解质溶液的pH增大
D.工作时负极区附近的pH增大
18.在酸性溶液中,可以大量共存的离子组是
A.Na+、Fe2+、Cl-、NO3- B.K+、S2-、SO42-、Na+
C.K+、NH4+、NO3-、OH- D.SO42-、NH4+、NO3-、Fe3+
17.浅绿色的Fe(NO3 )2溶液中存在如下平衡:Fe2++H2O Fe(OH)2+2H+,若向溶液中滴加足量盐酸,则溶液的颜色
Fe(OH)2+2H+,若向溶液中滴加足量盐酸,则溶液的颜色
A.变黄 B.绿色更深 C.绿色变浅 D.无变化
16.在四支干燥的试管里分别充满CO2、O2、NO2、NH3四种气体,将试管倒插入水槽里,轻轻掁荡,最终水上升到试管内的高度从低到高的顺序是
A.CO2、O2、NO2、NH3 B.O2、CO2、NO2、NH3
C. CO2、NO2、O2、NH3 D.CO2、NH3、O2、NO2
15.下列仪器中,没有“0”刻度线的是
A.温度计 B.量筒 C.酸式滴定管 D.托盘天平游码刻度尺
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com