
题目列表(包括答案和解析)
19.(1)①如果土壤中严重缺氧,又无其他杂散电流,按理说,金属是较难进行电化学腐蚀的,可事实上埋在地下的金属构件仍照样遭到严重的破坏,其腐蚀的特征是造成金属构件的局部损坏,并生成黑色而带有难闻气味的硫化物。你认为这可能由于__________引起的,且所发生的是以__________为主要类型的电化学腐蚀。
②多数土壤中都会有硫酸盐,如果有硫酸盐还有菌存在,它将产生生物催化作用,使SO42-氧化被吸附在铁表面的氢,从而促使析氢腐蚀顺利进行。其整个反应过程可表示为:
阳极 4Fe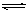 4Fe2++8e-???8H2O
4Fe2++8e-???8H2O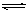 8H++8OH-
8H++8OH-
?阴极 8H++8e-=8H? ??SO42-+□=S2-+□(完成此电极反应式)
并发生如下两种化学反应,生成了两种二次腐蚀产物: 、________________(写离子方程式),总化学反应方程式为 。
(2)作为新一代工程材料,膨胀石墨有着日益广泛的新用途,如可作高级密封材料,也可作为新型的导电材料应用于电池生产中,还可作为新型的吸附剂用于环保上。它可由石墨在浓硫酸介质中被氧化而制得:3nH2SO4+ngraphite+n/2[O]=n/2H2O+[graphite+·HSO4-·2H2SO4]n?(石墨硫酸盐)石墨硫酸盐经水洗、过滤、干燥、高温加热后即得膨胀石墨产品。
①你认为在实际生产工艺中是什么原因造成石墨膨胀而最终制成石墨材料?
②题给反应中的还原剂是__________,反应中转移的电子总数为__________。
③石墨硫酸盐中可能存在的作用力包括________________。
18.二硫化钛(TiS2)是一种金属性导体,具有层状结构,而且容易使金属锂夹入,所以TiS2在蓄电池中可作理想的电极材料。若把TiS2作为一个电极,把金属锂作为另一个电极,用锂盐溶液作为电解质溶液组成原电池,则该蓄电池放电时:
负极反应为 ;
正极反应为 ;
总反应方程式为 。
15.在含有H2S气体的空气中,银器表面易变黑(生成了Ag2S),原因是银发生了______(填“析氢”或“吸氧”)腐蚀,其电极反应式为:正极______,负极______,最终在银器表面生成Ag2S的离子方程式是______。
为了除去银器表面的Ag2S,可采用如下方法:在一个铝制的容器中放入食盐溶液,将银器浸入食盐溶液,使银器与铝接触良好。过一段时间,银器表面变为银白色,并闻到臭鸡蛋的气味,观察到有少量白色絮状沉淀生成。请用电极反应式和离子方程式表示上述过程。


14.我国首创以铝-空气-海水电池为能源的新型海水标志灯已研制成功.这种灯以取之不尽的海水为电解质溶液,靠空气中氧气使铝不断氧化而产生电流.只要把灯放入海水中,数分钟后就会发出耀眼的闪光,其能量比干电池高20-50倍.试推测这种新型电池的负极是______,电极反应是______ ;正极是______,电极反应是___ __ _。
13.现有利用CO的燃烧反应,以熔融的碳酸钾为电解质,设计而成的原电池,写出该原电池的电极反应方程式。
12.一般说来,根据一个氧化还原反应便可设计一个电池。例如,某种燃料电池的总反应是CH4+2O2+2OH-=CO32-+3H2O.在此燃料电池中,向正极通入的物质是 ,负极发生的电极反应是 ,可选择的电解质是 。
11.铅蓄电池(原电池)的电极分别为PbO2和Pb,电解质溶液为稀硫酸溶液,工作时原电池的总反应是
PbO2+Pb+2H2SO4=2PbSO4+2H2O,根据上述变化,判断:
(l)原电池的负极是______(填电极材料);
(2)工作时蓄电池正极反应为______;
(3)工作时蓄电池里电解质溶液pH为______(选填增大,不变,变小)。
10.(97浙江)某原电池的总反应离子方程式为2Fe3++Fe=3Fe2+,不能实现该反应的是( )
A.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液
B.正极为Ag,负极为Fe,电解质溶液为CuSO4溶液
C.正极为Cu,负极为Fe,电解质溶液为FeCl3溶液
D.正极为石墨,负极为Fe,电解质溶液为Fe2(SO4)3溶液
9.一个完整的氧化还原反应方程式可以被拆写成两个“半反应”式,一个是“氧化反应”式,一个是“还原反应”式。如2Fe3++Cu=2Fe2++Cu2+的拆写结果:氧化反应Cu-2e=Cu2+;还原反应Fe3++e=Fe2+。
据此,请将反应式:3NO2+H2O=2H++2NO3-+NO拆写成两个半反应式:
氧化反应 ;还原反应______________________________。
8.在一铜片中央滴一滴稀硝酸银溶液,一段时间后洗去残留溶液,铜片表面出现一个银白色的亮斑。在亮斑和铜片的交界处滴一滴含NaCl和酚酞的溶液,数分钟后能观察到什么现象?为什么?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com