
题目列表(包括答案和解析)
2.注意用数学知识如图像、图表、函数等知识来解决化学问题.
1.在物理和化学中注意比较有些原理、定律具有相似性,如物理学中有机械守恒定律,化学中有质量守恒定律.
4.催化剂对化学反应速率的影响
催化剂能够降低反应所需的能量即所谓活化能(反应所需最低能量),这样就会使更多的反应物分子转化为活化分子,大大增加了单位体积内的活化分子数,从而大幅度改变化学反应速率.
值得注意的是,浓度对反应速率的影响有选择性,关键是看改变哪一物质的浓度,有效碰撞的次数是增大还是减小;温度、压强和催化剂的影响是广泛的,是对整个反应体系的影响,也就是对正、逆反应速率都会随之改变.
另外,活化分子数与活化分子百分数的意义是不同的.不同的外界条件对其影响的效果也有区别.浓度和压强,只能改变单位体积内活化分子总数,不会改变活化分子的百分数.温度和催化剂不仅能改变活化分子总数,同时能改变活化分子的百分数.
[难题巧解点拨]
例1:反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g)在2L的密闭容器中进行反应,1min后,NH3减少了0.12mol,则平均每秒钟浓度变化正确的是( )
4NO(g)+6H2O(g)在2L的密闭容器中进行反应,1min后,NH3减少了0.12mol,则平均每秒钟浓度变化正确的是( )
A.NO:0.001mol/L B.H2O:0.002mol/L
C.NH3:0.002mol/L D.O2:0.00125mol/L
分析:先求出v(NH3),再根据反应中各物质的速率之比等于化学计量数之比的原则,求出其它各物质的反应速率.
∵v(NH3)=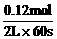 =0.001mol/(L·s)
=0.001mol/(L·s)
∴v(NO)=v(NH3)=0.001mol/(L·s) v(H2O)=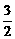 v(MH3)=0.0015mol/(L·s)
v(MH3)=0.0015mol/(L·s)
v(O2)=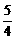 v(NH3)=0.00125mol/(L·s)
v(NH3)=0.00125mol/(L·s)
本题答案:A、D
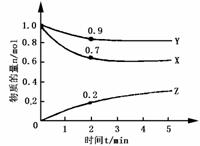
例2:某温度时,在2L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如下图所示.由图中数据分析,该反应的化学方程式为 ;反应开始至2min,Z的平均反应速率为 .(济南市检测题)
分析:由图示先确定反应物和生成物:X、Y随时间变化物质的量减少,说明为反应物,Z随时间变化而增多为生成物.再根据反应速率和各物质的计量数关系确定方程式.由于是在相同体积、相同时间内,有反应速率之比等于物质的量变化之比.
v(x)∶v(y)∶v(z)=△n(x)∶△n(y)∶△n(z)=(1.0-0.7)∶(1.0-0.9)∶(0.2-0)=3∶1∶2,故化学计量数之比为3∶1∶2.另外,从图中可知,经过一段时间各物质都不为零,所以该反应为可逆反应.
v(z)=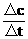 =
=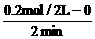 =0.05mol/(L·min)
=0.05mol/(L·min)
本题答案:3x+y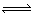 2z;0.05mol/(L·min)
2z;0.05mol/(L·min)
例3:可逆反应aA(气)+bB(气) 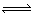 cc(气)+dD(气),取amolA和bmolB置于VL容器中,1min后,测得容器内A的浓度为xmol/L,这时B的浓度为
mol/L,C的浓度为
mol/L.这段时间内反应的平均速率若以物质A的浓度变化来表示,应为
.(上海高考题)
cc(气)+dD(气),取amolA和bmolB置于VL容器中,1min后,测得容器内A的浓度为xmol/L,这时B的浓度为
mol/L,C的浓度为
mol/L.这段时间内反应的平均速率若以物质A的浓度变化来表示,应为
.(上海高考题)
分析:[A]起始=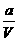 mol/L,[B]起始=
mol/L,[B]起始=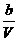 mol/L,[C]起始=0.
mol/L,[C]起始=0.
[A]减小=(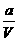 -x)mol/L,vA=
-x)mol/L,vA=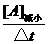 =
=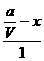 =(
=(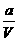 -x)mol/(L·min).
-x)mol/(L·min).
同一反应中,各物质的浓度变化之比等于方程式化学计量数之比,所以
[B]减小=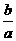 (
(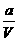 -x)mol/L,[C]增加=
-x)mol/L,[C]增加=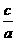 (
(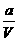 X)mol/L.1min后,[B]=
X)mol/L.1min后,[B]=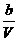 -
-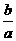 (
(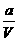 -x)=
-x)= 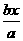 (mol/L),[C]=0+
(mol/L),[C]=0+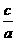 (
(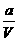 -x)=
-x)= 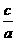 (
( 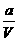 -x)(mol/L)
-x)(mol/L)
本题答案: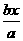 ;
;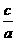 (
(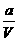 -x);(
-x);( 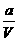 -x)mol/(L·min).
-x)mol/(L·min).
评析:计算容器内某物质存在的物质的量方法是:
①生成物:n(生)=n(始)+n(增);
②反应物:n(反)=n(始)-n(耗).
计算物质的量浓度的方法是:
①生成物:c(生)=c(始)+c(增);
②反应物:c(反)=c(始)+c(耗).
例4:把除去氧化膜的镁条投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示,其中t1-t2速率变化的主要原因是 ,t2-t3速率变化的主要原因是 .
分析:这是一道训练发散性思维的习题,解答此题主要依据图示速率曲线的变化,对照影响化学反应速率的相关因素进行分析.
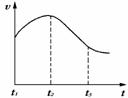
从图中可知速率曲线从t1时某一高度上升到t2后下降.这与盐酸的浓度随反应进行,t1→t2→t3逐渐减小,速率也应逐渐减小矛盾.然而事实就是这样.如何从影响反应速率的其他外界因素--压强、温度、催化剂角度去分析呢?从反应本质和反应外界条件来看,压强、催化剂(没加入催化剂)的影响均可排除.温度的影响是重点对象和关键.这就要看我们在做实验的时候,是否认真、细心观察所发生的一切现象,并有所感受.若从温度的影响来看肯定是升高了反应体的温度,且温度升高的影响大于浓度减小的影响,但并没有加热,所以只能是反应本身所产生的热量所致.t2→t3主要是浓度减小占主要影响因素了.
本题答案:因为反应放热,溶液温度升高,反应速率加快.因为随反应进行,盐酸的浓度减小较大,反应速度减慢.
[命题趋势分析]
化学反应速率为高考常考知识,多与化学平衡等知识结合,常以选择题形式出现,难度偏低.
3.温度对化学反应速率的影响
对任何反应的速率都有影响,升高温度可使非活化分子吸收能量转化为活化分子,从而增加单位体积内的活化分子数,单位时间内有效碰撞次数增多,化学反应速率随之加快.实验证明:温度每升高10℃化学反应速率通常会增大到原来的2-4倍.
2.压强对化学反应速率的影响
对气体参加的化学反应而言,增大压强,则气体体积缩小,相当于增大了浓度,单位体积内活化分子数增加,单位时间内有效碰撞次数增多,化学反应速率加快.减小压强,气体体积增大,相当于减小了浓度,单位体积内的活化分子数减少,单位时间内有效碰撞次数减少,化学反应速率减小.
但压强对只有固体、纯液体或溶液参加的反应无影响,因压强的变化对它们的体积改变极小,因而对它们的浓度几乎无影响,故可忽略.
1.浓度对化学反应速率的影响
对气体或溶液中发生的反应,在其他条件不变时,增加反应物的浓度,单位体积内的活化分子数增加,单位时间内有效碰撞次数增多,化学反应速度增大.减小反应物的浓度,单位体积内的活化分子数减少,单位时间内有效碰撞次数减少,化学反应速率减小.
对固体或纯液体(不是溶液)的反应,因在一定温度下都有一定的密度,单位体积内所含微粒数是一定的,其浓度是一定值.因此,其反应速率只与接触面积和扩散速率大小有关.增大接触面积(如将固体粉碎)或增大扩散速率(如对反应物进行搅拌)可提高反应速率.
0.8>0.5>0.4>0.35,故④情况下反应速率最快.
本题答案:D
[重点难点解析]
重点:浓度对化学反应速度的影响.
难点:浓度对化学反应速率影响的原因.
化学反应有的能自发进行,有的不能自发进行.能否自发进行和进行反应的速率,都取决于反应物质本身的结构和性质.外界条件不能改变其本性.
在讨论影响反应速率的外界条件时,要抓住关键,主要看单位体积内活化分子总数量增加还是减少,有效碰撞的次数是增大还是减小.
3.影响化学反应速率的因素
(1)内因:不同的化学反应具有不同的反应速率,影响化学反应速率的决定因素是内因,即由参加反应的物质本身的性质所决定.
(2)外因:在同一反应中,影响化学反应速率的外界条件主要有浓度、温度、压强、催化剂等.改变了这些条件,可以改变化学反应速率,其根本原因是改变了单位体积内活化分子的数目,也就改变了分子间发生有效碰撞的机会,从而改变了化学反应速率.
(3)其它条件:除上述四种常见的反应条件外,还有光、超声波、激光、放射线、电磁波等均可改变化学反应速率.
由于在同一个反应中用不同的物质来表示速率时,其数值可以是不同的,在比较反应速度大小时,不仅要看反应速率数值的大小,还要结合化学方程式中物质的化学计量数的大小进行比较.
例题: 可逆反应2A(g)+3B(g) 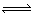 2c(g)+D(g)
2c(g)+D(g)
在四种不同条件下的反应速率分别为:
①υ(A)=0.5mol/(L·min) ②υ(B)=0.6mol/(L·min)
③υ(C)=0.35mol/(L·min) ④υ(D)=0.4mol/(L·min)
则该反应在不同条件下反应速率最快的是( )
A.① B.② C.③ D.④
分析: 在同一反应中,化学反应速率用不同物质的浓度变化表示,无法判断其反应速率的慢快,需要根据反应速率之比等于物质的化学计量数之比换算成用同一物质表示的反应速率的数值才能比较其快慢程度.现将上述反应速率都用A的变化表示:
①v(A)=0.5mol(L·min)
②v(A)=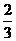 v(B)=0.4mol/(L·min)
v(B)=0.4mol/(L·min)
③v(A)=v(C)=0.35mol/(L·min)
④v(A)=2v(D)=0.8mol/(L·min)
2.化学反应速率及表示方法
化学反应的快慢本质上是由单位体积内的活化分子数决定的.单位体积内的活化分子数越多,则化学反应速率越快;反之,则慢.
化学反应速率是用来衡量化学反应进行快慢的尺度.常用单位时间内反应物浓度的减少或生成物浓度的增加来表示.
某一物质的化学反应速率的计算式为:
v=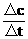
式中△c为浓度变化,单位常用mol/L表示;△t为时间,单位常用min、s表示.因此,反应速率v的单位为mol/(L·min)、mol/(L·s)等.
(1)同一反应用不同的物质的浓度变化表示其反应速率时,其数值可以是不同的,但都表示该反应的反应速率.因此,在表示化学反应速率时,必须注明是以哪种物质作标准.
(2)同一反应用不同的物质的浓度变化表示时,速率之比等于化学方程式中相应的化学计量数之比.如,化学反应mA+mB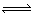 pC+qD,有υ(A)∶υ(B)∶υ(C)∶υ(D)=m∶n∶p∶q.
pC+qD,有υ(A)∶υ(B)∶υ(C)∶υ(D)=m∶n∶p∶q.
(3)实际上,大部分化学反应速率都是随着时间不断地改变的,我们所讲的化学反应速率是指一段时间内的平均速率,而不是指某一时刻的瞬时速率.
(4)化学反应速率不取负值.
1.有效碰撞与活化分子
化学反应的实质是反应物分子中化学键的断裂,生成物分子中化学键的形成过程,而旧键的断裂和新键的形成都需要通过分子(或离子)的相互碰撞才能实现.
分子间的碰撞接触是发生化学反应的先决条件,但是分子间的碰撞不一定每一次都能发生反应.我们把能够发生化学反应的碰撞称为有效碰撞.
什么样的分子能发生有效碰撞呢?理论和实践都证明只有具有足够能量的分子才能发生有效碰撞.具有足够能量的分子,其分子内原子振动加剧,在发生碰撞后,促使化学键疏松导致破裂,使原子间重新形成新的化学键而结合成新的分子.我们把能够发生有效碰撞的分子称为活化分子.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com