
题目列表(包括答案和解析)
21.(共8分)氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现有0.001mol/L酸性KMnO4和未知浓度的无色NaHSO3溶液,反应离子方程式是2MnO4- + 5HSO3- + H+ ===2Mn2+ + 5SO42- + 3H2O 填空回答问题: (1)该滴定实验所需仪器有下列中的______________________________(填序号) A.酸式滴定管 B.碱式滴定管 C.量筒 D.锥形瓶 E.铁架台 F.滴定管夹 G.烧杯 H.白纸 I.胶头滴管 J.漏斗 (2)滴定前平视KMnO4溶液,刻度为a mL,若滴定后(终点)俯视液面刻度为b mL,则(b-a)mL比实际消耗KMnO4溶液体积_________( 多、少)。根据(b-a)mL计算得到的待测液浓度比实际的浓度_________(大、小)。若滴定后(终点)平视液面刻度为c mL,假设被滴定的未知浓度NaHSO3溶液的体积为V mL,请写出求NaHSO3溶液的物质的量浓度的计算式:___________________________________________________________
20.(共10分,每2分)下图中的每一个方格表示有关的一种反应物或生成物,其中A,C,D为无色气体.请填下列空白:

(1)物质X可以是______________________,C 是____________,F是____________. (2)反应①化学方程式是________________________________________________ (3)反应②的离子方程式是______________________________________________
18.(8分)pH=13的强碱溶液与pH=2的强酸溶液混合,若所得混合液的pH=7,则强 碱与强酸的体积比是:______________ ;若所得混合液的PH=11,则强碱与强酸的体积比是:___________. PH=2的盐酸与 PH=5的盐酸等体积混合后所得溶液的PH为________,PH=8的氢氧化钾溶液与 PH=11的氢氧钾溶液等体积混合后所得溶液的PH为_________. 19.(共10分,每空2分)在一定温度下,把2摩A和1摩B通入一个一定容积的密闭的容器里,发生如下反应:
 2A(g)+B(g) 2C(g)
2A(g)+B(g) 2C(g) |
当此反应进行到一定程度时,反应混和物就处于化学平衡状态.现在该容器中,维持温度不变,令a、b、c分别代表初始加入的A、B和C的物质的量(摩).如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的百分含量仍跟上述平衡时的完全相同.请填写下列空白: (1)若a=0,b=0,则c= ______. (2)若a=0.5,则b=_______ 和c=______ . (3)a、b、c取值必须满足的一般条件是(请用两个方程式表示,其中一个只含a和c,另一个只含b和c):①__________________.②_____________________
____________________________ , ②在氢氧化钠溶液中加入少量的氯化铝溶液,可观察到 现象: ______________________________________________ , 写出①的化学方程式: __________________________________________________________,写出②的离子方程式 __________________________________________________________.
17. (共4分,每空2分)1995年诺贝尔化学奖授予致力于研究臭氧层被破坏问题的三位环境化学家。大气中的臭氧层可滤除大量的紫外光,保护地球上的生物。氟利昂(如CCl2F2可在光的作用下分解,产生Cl原子,Cl原子会对臭氧层产生长久的破坏作用(臭氧的分子式为O3)。有关反应为:
(共4分,每空2分)1995年诺贝尔化学奖授予致力于研究臭氧层被破坏问题的三位环境化学家。大气中的臭氧层可滤除大量的紫外光,保护地球上的生物。氟利昂(如CCl2F2可在光的作用下分解,产生Cl原子,Cl原子会对臭氧层产生长久的破坏作用(臭氧的分子式为O3)。有关反应为:

在上述臭氧变成氧气的反应过程中,Cl的作用是:_______________,写出上述 反应的总反应方程式为:_______________________________________________
15.a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg 5种金属中的一种.已知:(1)a、c均能与稀硫酸反应放出气体;(2)b与d的硝酸盐反应,置换出单质d;(3)c与强碱反应放出气体;(4)c、e在冷浓硫酸中发生钝化.由此可判断a、b、c、d、e依次为 ( ) A.Mg Cu Al Ag Fe
B.Al Cu Ag Fe Mg C. Fe Cu Ag Mg Al
D.Mg Al Cu Fe Ag
高二化学第一学期期中考试试卷
(化学班用)
第Ⅱ卷(非选择题 共90分)
班级________姓名___________学号_________成绩________
13.下图表示外界条件(温度、压强)的变化对下列反应的影响:
 L(g)+G(g)
3R(g)(正反应为吸热反应),则图中Y轴是指( )
L(g)+G(g)
3R(g)(正反应为吸热反应),则图中Y轴是指( )

A. 平衡混合气中R的质量分数
B. R的产率
C. 平衡混合气中G的质量分数
 D. G的转化率
D. G的转化率
14.下列各组离子,在溶液中不能大量共存的是( )
A.NO3- Fe3+ Cl- H+ B. Na+ OH- NH4+ AlO2-
C. Al3+ NO3- S2- OH- D. K+ OH- Na+ S2-
12. 4NH3(g)+5O2(g)
4NO(g)+6H2O(g)在10 L密闭容器中进行,10s后,水蒸气的物质的量增加了0.60 mol,则此反应的平均速率
4NH3(g)+5O2(g)
4NO(g)+6H2O(g)在10 L密闭容器中进行,10s后,水蒸气的物质的量增加了0.60 mol,则此反应的平均速率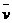 (X)(反应物的消耗速率或产物的生成速率)可表示为( )
(X)(反应物的消耗速率或产物的生成速率)可表示为( )
A. 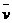 (NH3)=0.0060 mol/(L·s)
(NH3)=0.0060 mol/(L·s)
B. 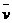 (NO)=0.0040
mol/(L·s)
(NO)=0.0040
mol/(L·s)
C. 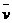 (O2)=0.0060 mol/(L·s)
(O2)=0.0060 mol/(L·s)
D. 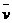 (H2O)=0.36 mol/(L.min)
(H2O)=0.36 mol/(L.min)
11.下列属于纯净物的是( )
A.五水硫酸铜晶体 B.氨水
C.漂白粉 D.液氨
10. 下列液体pH>7的是( )
下列液体pH>7的是( )
A. 胃液 B. 食醋 C. 葡萄汁 D. 人体血液
9. 反应2A(g)+B(g)
2Z(g)+Q,在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n(Z)与反应时间(t)的关系如下图所示。下述判断
反应2A(g)+B(g)
2Z(g)+Q,在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n(Z)与反应时间(t)的关系如下图所示。下述判断
 正确的是( )
正确的是( )
A. T1>T2,p1>p2
B.T1<T2,p1>p2
C. T1<T2,p1<p2
D.T1>T2,p1<p2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com