
题目列表(包括答案和解析)
25、由NO2和O2组成的混合气体40ml,通过足量的水后剩余气体5ml,则原混合气体中NO2和O2的体积比为多少?
24、双氧水(H2O2)和水都是极弱的电解质,但H2O2比H20更显酸性。
(1)若把H2O2看成是二元弱酸,请写出它在水中的电离方程式:
_______________________________________________________________
(2)鉴于H2O2显弱酸性,它能同强碱作用形成正盐,在一定条件下也可以形
成酸式盐。请写出H2O2与Ba(OH)2作用形成正盐的化学方程式:
________________________________________________________________
(3)水电离生成H3O+和OH -叫做水的自偶电离。同水一样,H2O2也有极微弱的自偶电离,其自偶电离的方程式为 _____________________________________
23、某温度下,纯水中的[H +]=2.0×10-7mol/L,则纯水中的[OH -]=____________;
若温度不变,滴入稀盐酸使溶液中[H +]=5.0×10-6mol/L,则溶液中的
[OH -]=_______________
22、配平下列氧化-还原反应的化学方程式,并填空:
P4+ CuSO4+ H2O--- Cu+ H3PO4+ H2SO4
氧化剂是 ,电子转移总数是
21、在一定温度下,密闭容器中A+B 2C类型的反应达到了平衡
2C类型的反应达到了平衡
(1)当增加或减少A物质时,平衡不移动,则A的物质状态为__________;
(2)升高温度,平衡向右移动,此正反应是______热反应;升高温度时,正
反应速率_________,逆反应速率__________(填增大、减少或不变)。
(3)若B物质为气态,增加压强时平衡不移动,则A物质为_____态,C物质为______态
20、 实验室用N2、H2合成氨气,并用酚酞试液检验生成的氨气,用锌与盐 酸反应制取氢气;用NaNO2饱和溶液和NH4Cl饱和溶液共热制取氮气:
 NaNO2+NH4Cl=NaCl
+ NH4NO2
NaNO2+NH4Cl=NaCl
+ NH4NO2
NH4NO2 N2↑+2H2O。
制取装置如图所示:
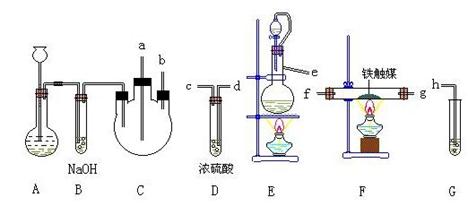
(1)装置A用于制取 ;B装置的作用是___________________________;
C 装置的作用是____________________________________.。
(2)装置E中分液漏斗上方常用导管与园底烧瓶相通,作用 是 。装置E与装置C直接相连,连接时导管口连接方法为e接 。
(3)装置C的另一接口与其他仪器装置相连接时,导管口的连接顺序为:
另一接口 接 , 接 , 接 。
(4)装置D的作用为 。装置F导出的气体的成分为
(5)装置G内滴有酚酞的试液,用于检验氨气的生成,该装置中导管口能否插入液面以下 (填“能”或“不能”),理由是 。
(6)从充分利用原料的角度看,装置G应装双孔塞,此时另一接口应与 相连为佳。
19、用中和滴定的方法测定NaOH和NaCO3混合液中的NaOH含量时,可先在混合
液中加过量的BaCl2溶液,使Na2CO3完全转化为BaCO3沉淀,然后用标准
HCl溶液滴定(用酚酞作指示剂)。回答下列问题:
(1)向混有BaCO3沉淀的NaOH溶液中滴入HCl,为什么不会使BaCO3溶解
而且还可以测定NaOH的含量___________________________________
______________________________________。
(2)滴定终点时,溶液颜色如何突变_____________________________。
(3)在此实验中,若没有滴定管量取混合液,可用什么仪器来代替______
_______________
(4)下列操作,能引起测定结果偏高的是______________
A、滴定前用标准液润洗滴定管
B、滴定结束后俯视滴定管读数
C、滴定前用待测液润洗锥形瓶
D、若用甲基橙作指示剂
18、PH=1的两种酸溶液A、B各1ml,分别加入水稀释到1000ml,其PH值与溶 液体积(V)的关系如图所示,下列说法正确的是( )
A、A、B两种酸溶液的物质的量浓度一定相等
 B、稀释后,A酸溶液的酸性比B酸溶液强 PH
B、稀释后,A酸溶液的酸性比B酸溶液强 PH


 C、若a=4,则A是强酸,B是弱酸
a
A
C、若a=4,则A是强酸,B是弱酸
a
A
D、若1<a<4,则A、B都是弱酸
 B
B

 1
1
 0
0
1000(ml)
17、在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和PH都相等,
向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气。下列说法正确的是( )
A.甲烧杯中放入锌的质量比乙烧杯中放入锌的质量大
B.甲烧杯中的酸过量
C.两烧杯中参加反应的锌等量
D.反应开始后乙烧杯中的[H+]始终比甲烧杯中的[H+]小
16、将1.92g铜粉与一定量浓硝酸反应,随着铜的不断减少,反应生成的气体 颜色也逐渐变浅,当铜粉反应完全时,共收集到1.12L(标准状况下)气体, 则反应中消耗硝酸的物质的量是 ( )
A、0.12mol B、0.11mol C、0.09mol D、0.08mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com