
题目列表(包括答案和解析)
3、 中和滴定开始后应注视:①滴定管内液面的变化 ②锥形瓶中溶液颜色的变化 ③滴定管溶液流出的速率
A、①和② B、②和③
C、①和③ D、只有②
2、 纯水在10℃和80℃时的pH,前者和后者的关系是:
A、前者大 B、前者小
C、相等 D、不能确定
1、 决定化学反应速率的主要因素是:
A、反应物的浓度 B、反应温度
C、使用催化剂 D、反应物的性质
32.喷泉是自然界中的一种现象。在实验室中,利用气体和溶剂的某种性质,在一特定装置中,也能模拟自然界的现象,形成美丽的喷泉。
1)烧瓶已充满某种气体X,气体体积为1000mL(273K,
101325Pa),烧杯中盛满水,直导管长L=60cm,导管
进入烧杯12cm,气体的溶解度在273K时为1:40
(1体积水能溶解101325Pa下气体40体积)。实验
开始,胶头滴管先向烧瓶中注入1mL水,通过计算
确定能否看到喷泉现象。假设压强的微小变化对气体溶解度的影响可忽略不计。
2)某学生试图用氨气和水去做喷泉实验,结果实验失败。试分析实验失败的可能原因。
31.在373K时,把0.125molN2O4气体通入体积为500mL的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2含量为0.01mol,进行到60s时达到平衡,此时容器内混合气体密度是氢气密度的28.75倍,则求:
1)开始2s内,以N2O4表示的反应速率
2)达平衡时,体系的压强是开始时的多少倍?
3)N2O4的平衡浓度
4)平衡后,若压缩容器体积,再达平衡后NO2的浓度如何变化。
附加题
30.标准状况下,用一充满氨气的圆底烧瓶做喷泉实验,实验完毕后,圆底烧瓶中充入水的体积为其容积的4/5,
1)求圆底烧瓶中NH3的体积分数
2)求所得氨水一物质的量浓度
3)若测得上述氨水的密度为0.95g/cm3,求此氨水中溶质的质量分数
29.据下图装置进行实验,回答下列问题。
1)在受热的试管中A处的Na2O2
发生反应的化学方程式(并标出
电子转移方向和数目):
①________________________
②________________________
2)被加热的铂丝处发生反应的化学方程式________________________
3)B管内出现的现象____________
4)烧杯C中发生的现象____________________________________
5)B管、烧杯C中可能发生的主要反应的方程式________________________
28.有两个起始体积相同的密闭容器A和B,A容器有一个可移动的活塞,能使容器内保
持恒压;B容器为固定体积。起始时向这两个容器中分别充入等量的体积比为2:1的SO2和O2的混合气,并使A、B容器中气体体积相等。在保持400℃条件下发生反应:2SO2+O2⇋2SO3,并达到平衡。
1)达到平衡所需时间A容器比B容器________,两容器中SO2的转化率A比B______。
2)达到(1)所述平衡后,若向容器中通入数量不多的等量氩气,A容器的化学平衡
____________移动,B容器的化学平衡____________移动。
3)达到(1)所述平衡后,若向容器中通入等量的原混合气,重新达到平衡后,A容器中SO3
的体积分数____________,B容器中SO3的体积分数____________。
27.1)16.8gCu与30mL 98%的浓H2SO4(ρ=1.84 g/cm3)完全反应,可生成硫酸铜
____________克,其中有多少____________克硫酸被还原。
2)在容积为3L的密闭容器中盛有N2和H2,在一定条件下发生反应,经过5min后达到
化学平衡,此时容器中含有0.9molN2, 1.2molH2, 3molNH3,则H2起始浓度为____________,H2的转化率____________用H2表示的反应速率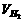 =____________,平衡时混合气体的平均相对分子质量为____________。
=____________,平衡时混合气体的平均相对分子质量为____________。
3)有可逆反应A(g)+B(g)⇋3C(g),下图分别表示在不同条件下,生成物C在反
应混和物中的百分含量(C%)和反应时间(t)的关系图
按下述要求填空写答案(A)甲图中两条曲线分别表示有无催化剂时的情况,则_ __________曲线表示无催化剂;(B)若乙图曲线a表示200℃和b表示100℃的情况,则该可逆反应的正反应是____________热反应;(C)若丙图中两条曲线分别表示不同压强下的情况,则____________曲线是表示压强较大时的情况。
4)将VmLNO和NO2的混和气通过水吸收后,得到a mL无色气体A,将此无色气体A
与等体积O2体积混合,再通过水充分吸收后,收集到5mL无色气体B,试回答:
①A气体是____________,B气体是____________
②A气体的体积是____________mL
③V的取值范围是____________
26.配平下列反应的化学方程式并填空:
1) NH3+ O2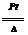 NO+ H2O,若有1.204×1024个电子发生转移,则被还原的物质的
NO+ H2O,若有1.204×1024个电子发生转移,则被还原的物质的
量是_______________mol。
2)在下列反应中, KNO2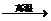 K2O+ NO↑+ O2↑,当有22.4LNO(S.T.P)生成
K2O+ NO↑+ O2↑,当有22.4LNO(S.T.P)生成
时,则被氧化的氧原子的物质的量是_______________mol。
3)配平下列化学方程式 Fe+H2SO4(浓)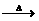 Fe2(SO4)3+ SO2↑+ H2O被还原的
Fe2(SO4)3+ SO2↑+ H2O被还原的
H2SO4与未被还原的H2SO4物质的量之比是____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com