
题目列表(包括答案和解析)
2.某元素的原子序数为7,对它的认识有错误的是( )
A.它处于元素周期表中第二周期VA族
B.它的最高正价为+5,负价为 -3
C.它的最高价氧化物对应水化物是一种强酸
D.它的非金属性比磷弱比氧强
1.在VA族元素中下列叙述正确的是( )
A.最外层均有5个电子
B.在气态氢化物中都是显+3价
C.最高价氧化物对应水化物为H3RO4或HRO3,显酸性
D.非金属性随核电荷数的递增而增强
40.称取某金属氧化物(MO)14.94g,将它溶于稀H2SO4中,然后再加蒸馏水稀释至250mL.取这种溶液50mL,加入适量其他物质,用铂做电极进行电解得到2.348g这种纯金属.试回答: (1)M是下列哪一种金属:Mg、Ni、Cu、Ca、Pb
(2)析出2.348g金属时,消耗多少摩电子?多少库仑电量?(每摩电子电量为96500库仑)
(3)最初溶液中,金属离子的摩尔浓度是多少?
39、一定条件下,可逆反应A2+B2 2C达到平衡后,c(A2)=0.5mol/L,c(B2)=0.1mol/L,c(C)=1.6mol/L。若A2、B2、C的起始浓度分别为amol/L、bmol/L、gmol/L。请确定:
2C达到平衡后,c(A2)=0.5mol/L,c(B2)=0.1mol/L,c(C)=1.6mol/L。若A2、B2、C的起始浓度分别为amol/L、bmol/L、gmol/L。请确定:
⑴a、b应满足的关系式__________________
⑵若反应从正反应方向开始进行,当g=____________是,a有最大值为__________
⑶若反应从逆反应方向开始进行,当b=____________是,a有最小值为__________
⑷综合⑵、⑶的结论,可知本题中a的取值范围为____________________________。
38、如图所示:以石墨为电极电解A的水溶液,并做下面一系列实验,试根据实验现象完成下列问题。电解质A的水溶液焰色反应呈浅紫色。
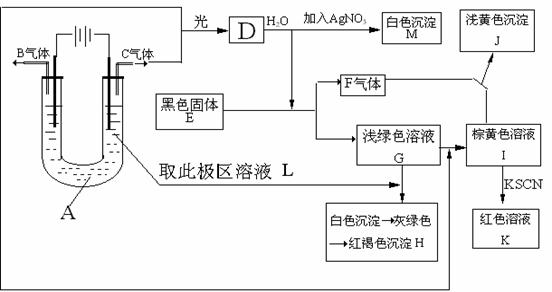
(1)、写出A的化学式为 ,E的名称为 。
(2)、I与F作用的离子方程式是
(3)、G加入L后产生的白色沉淀到生成红褐色沉淀H的化学方程式:
(4)、用两个最直接的离子方程式来证明Fe3+、Cu2+、Fe2+的氧化性强弱顺序是Fe3+>Cu2+>Fe2+ ①、
②、
37、有一瓶澄清的溶液,其中可能含有NH4+ 、 K+ 、 Na+ 、 Mg2+、 Ba2+ 、 Al3+ 、Fe3+、Cl-、I-、 NO3-、CO32 -、S2- 、SO42- 、AlO2- 、SO32-、MnO4- , 取该溶液进行以下实验:
(1)、取PH试纸检验,溶液呈强酸性,可以排除 离子的存在。
(2)、取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4层呈紫红色,可以排除 离子的存在。
(3)、另取出部分溶液逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生,则又可以排除 离子的存在。
(4)、取出部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成,证明 离子存在,又可排除 离子存在。
(5)、将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定:该溶液中肯定存在的离子是
肯定不存在的离子是
还不能确定是否存在的离子是
36.某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验:
(1)取样品ag,称取时使用的仪器名称为 .
(2)将样品溶解于足量的稀盐酸中,过滤,滤液中主要含有 ,滤渣中含有 ;在溶解、过滤时使用的仪器有 .
(3)往滤液中加入过量NaOH溶液,过滤.写出该步操作中有关的离子方程式 , , .
(4)在第(3)步的滤液中通入足量CO2,过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至质量不再减少为止,冷却后称重质量为bg.有关的化学方程式为 , .
(5)该样品中铝的质量分数的表达式为 .
(6)若第(3)步中加入NaOH的量不足时,会使测定的结果(偏高、偏低、不影响) .
若第(4)步中的沉淀没有用蒸馏水洗涤时,会使测定的结果(偏高、偏低、不影响) .
若第(4)步中对沉淀的灼烧不充分时,会使测定的结果(偏高、偏低、不影响) .
35.将石墨电极A和B,浸入盛有200g10%的硝酸银溶液的烧杯中,将直流电源P、Q两极分别与A、B相连,通电一段时间后,A极因附着析出物质,而增至2.16g,则B极逸出气体质量为 g,电源的P极是 极,A极发生 反应,电解反应式为 ,此时硝酸银溶液的质量百分比浓度为 .
34.在CH3COOH的水溶液中加入少量固体CH3COONa后,溶液的PH值变 ;其原因是(用文字和相应的离子方程式简要叙述) .在该混合液中滴入少量稀H2SO4时,其PH值基本不变,原因是 .
33.现有甲、乙两瓶无色溶液,已知它们可能是AlCl3溶液和NaOH溶液.现做如下实验:
①取440ml甲与120ml乙反应,产生1.56g沉淀;
②取440ml乙与120ml甲反应,也产生1.56g沉淀;
③取120ml甲溶液与400ml乙溶液反应,则产生3.12g沉淀;
通过必要的计算和推理判定:
(1)甲溶液为 溶液,其物质的量浓度为 .mol·L-1;乙溶液为 溶液,其物质的量浓度是 mol·L-1
(2)写出实验③的有关离子方程式 .
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com