
题目列表(包括答案和解析)
7.现有甲、乙两瓶无色溶液,已知它们可能是AlCl3溶液和NaOH溶液.现做如下实验:
①取440ml甲与120ml乙反应,产生1.56g沉淀;
②取440ml乙与120ml甲反应,也产生1.56g沉淀;
③取120ml甲溶液与400ml乙溶液反应,则产生3.12g沉淀;
通过必要的计算和推理判定:
(1)甲溶液为 溶液,其物质的量浓度为 .mol·L-1;乙溶液为 溶液,其物质的量浓度是 mol·L-1
(2)写出实验③的有关离子方程式 .
6.在某化工生产中要用到一种无色、可溶于水的晶体--铝铵矾.该晶体是一种复盐,其主要成分为十二水合硫酸铝铵.向该复盐的浓溶液中逐滴加入浓NaOH溶液,将发生一系列变化.已知NH+4与AlO-2在水溶液中不能大量共存,会发生如下反应: +
+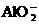 +H2O=Al(OH)3↓+NH3
+H2O=Al(OH)3↓+NH3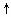
试回答:
(1)在硫酸铝铵水溶液中滴入石蕊试液,观察到的现象是 ,其原因是 .
(2)在逐滴加入浓NaOH溶液的过程中,产生的现象有:
①溶液中出现白色沉淀,②有刺激性气味的气体逸出;
③白色沉淀量逐渐增多;④白色沉淀完全消失;
⑤白色沉淀量逐渐减少.请回答出各种现象由先到后的顺序 .
(3)写出滴入NaOH溶液的过程中,有关反应的离子方程式:① ,② ,③ .
5.有A、B两瓶氨水,浓度分别为1mol/L和0.1mol/L,则A、B两瓶氨水中[OH-]的比
10.(用大于、小于、等于填写).其理由是 .
4.取相同体积(0.025L)的两份0.01mol/LNaOH溶液,把其中一份放在空气中一段时间后,溶液的PH值 (填增大、减小或不变),其原因是 .用已知浓度的硫酸溶液中和上述两份溶液,若中和第一份(在空气中放置一段时间)所消耗硫酸溶液的体积为VA,另一份消耗硫酸溶液的体积为VB,则:(1)以甲基橙为指示剂时,VA与VB的关系是 ,(2)以酚酞为指示剂时,VA与VB的关系是 .
3.在硫化氢的饱和溶液中存在的电离平衡是:
H2S+H2O
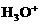 +HS-,HS-+H2O
+HS-,HS-+H2O
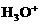 +S2-
+S2-
(1)其中[HS-] [S2-],[HS-] [H+],[H+] [S2-](大于、小于或等于)
(2)若加NaOH固体,[S2-]将 ,S2-的物质的量将 溶液的PH值将 .
(3)若加入无水CuSO4,[S2-]将 ,电离平衡向 移动,溶液的PH值将 .
2.一定温度下,在冰醋酸的加水稀释过程中,溶液的导电能力Ⅰ随加入水的体积V变化的曲线如图所示,请回答:
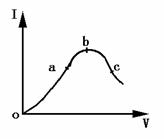
(1)“O”点导电能力为O的理由是 .
(2)a,b,c三点处,溶液中c(H+)由大到小的顺序为 .
(3)a,b,c三点处,PH由大到小的顺序为 .
(4)若使c点溶液中c(Ac-)增大,溶液中c(H+)减小,可采取的措施是:(1) , (2) ,(3) .
1.某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:H2A H++HA- HA-
H++HA- HA- H++A2-已知相同浓度时H2A的电离程度大于HA-的电离程度,设有下列四种溶液:
H++A2-已知相同浓度时H2A的电离程度大于HA-的电离程度,设有下列四种溶液:
A.0.01mol/L的H2A溶液
B.0.01mol/L的NaHA溶液
C.0.02mol/L的HCl与0.04mol/L的NaHA溶液等体积混合液
D.0.02mol/L的NaOH与0.02mol/L的NaHA溶液等体积混合液
据此,填写下列空白(填代号)
(1)c(H+)最大的是 ,最小的是 .
(2)c(H2A)最大的是 ,最小的是 .
(3)c(A2-)最大的是 ,最小的是 .
12.NaH是离子化合物,与水反应可生成碱和H2.现有NaH与铝粉混合物共mg,与足量水反应共收集到H2 ng,则原混合物中铝粉质量为( )
①(12n-m)g ②(24m-5n)g
③(36n-3m)g ④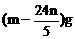
A.①② B.①③ C.③④ D.②④
11.向一定体积一定浓度的Al2(SO4)3溶液中加入33ml某浓度的NaOH溶液,有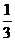 的Al3+转化为Al(OH)3,则使其中2/3的Al3+转化为Al(OH)3,所加入NaOH溶液的体积可能是下列数据①18ml ②30ml ③66ml ④110ml中的( )
的Al3+转化为Al(OH)3,则使其中2/3的Al3+转化为Al(OH)3,所加入NaOH溶液的体积可能是下列数据①18ml ②30ml ③66ml ④110ml中的( )
A.只有③ B.只有③④
C.全部 D.缺少数据,无法计算
10.铝与Na2O2的混合物溶于足量水中,得到澄清溶液,同时产生气体3.5g,在所得溶液与7mol/LHCl 100mL作用过程中,先有白色沉淀生成,此后沉淀又恰好溶解,则Al与Na2O2的物质的量之比为( )
A.2∶1 B.1∶2 C.11∶2 D.2∶11
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com