
题目列表(包括答案和解析)
13、人体血红蛋白中含有Fe2+离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转变为Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐的中毒,主要由于维生素C具有
A、酸性 B、碱性 C、氧化性 D、还原性
12、下列物质中,属于两性氧化物的是
A、 MgO B、 CO2 C、 Al2O3 D、 SO2
11、硝酸应避光保存是因为它具有
A、不稳定性 B、强酸性 C、强氧化性 D、挥发性
10、随着人们生活质量不断提高废电池必须集中处理的问题提到议事日程,其主要原因是
A、利用电池外壳的金属材料
B、防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C、不使电池中渗泄的电解液腐蚀其他物品
D、回收其中的石墨电极
9、下列电离方程式正确的是
A、H2S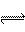 2H+ + S2- B、NaHCO3 == Na+ + H+ + CO32-
2H+ + S2- B、NaHCO3 == Na+ + H+ + CO32-
C、H2CO3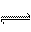 H+ + HCO3- D、HClO == H+ + ClO-
H+ + HCO3- D、HClO == H+ + ClO-
8、碳酸钠俗称纯碱,其原因是
A、由于碳酸钠的纯度很高 B、由于其物质的分类属于碱类
C、由于碳酸钠和酸反应生成盐和水 D、由于碳酸钠水溶液的碱性较强
7、对于达到平衡状态的可逆反应:N2+3H2 2NH3(正反应为放热反应)下列叙述正确的是:
2NH3(正反应为放热反应)下列叙述正确的是:
A、反应物和生成物的浓度相等 B、N2和H2的浓度之比一定为1:3
C、降低温度,平衡混合物里NH3的浓度增大 D、增大压强,不利于氨的合成
6、在一定条件下,发生反应:2NO2 N2O4,该反应达到化学平衡后,降低温度,混合物的颜色变浅,下列有关说法正确的是
N2O4,该反应达到化学平衡后,降低温度,混合物的颜色变浅,下列有关说法正确的是
A、正反应为放热反应 B、正反应为吸热反应
C、降温后NO2的浓度增大 D、降温后各物质的浓度不变
5、化学平衡发生移动的原因是
A、正反应速率与逆反应速率都发生了变化
B、正反应速率与逆反应速率都加快了
C、正反应速率不等于逆反应速率
D、平衡混合物中,各组分成分的浓度都发生了变化
4、某一反应物的浓度是2.0mol/L,经过20s后,它的浓度变成了0.4mol/L,在这20s内它的反应速率为
A、0.1 mol/(L·s) B、0.08mol/(L·s) C、1.6mol/(L·s) D、0.02 mol/(L·s)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com