
题目列表(包括答案和解析)
23.0.02mol/L的HCN溶液与0.02mol/L NaCN溶液等体积混合,已知该混合溶液中 ,用“>、<、=”符号填空
,用“>、<、=”符号填空
①溶液中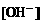
 ②[HCN]
②[HCN]

③[HCN]+ 0.02mol/L
0.02mol/L
22.25℃时,在浓度均为0.1mol/l(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2三种溶液中,若测得其中NH4+离子浓度分别为a、b、c,则a、b、c的大小关系为 。
21.将PH值都等于3的醋酸和盐酸,加水稀释到a ml和b ml,测得稀释后的溶液PH值均为5,则稀释后两溶液的体积 (填“=”、“>”、“<”、“无法确定”=
20.在25℃时,若10体积的某强酸溶液与1体积的某强碱溶液混和后溶液呈中性,则混和之前,该强酸pH值与强碱pH值之间应满足的关系是 .
19.用标准盐酸滴定未知浓度NaOH溶液,下列各操作中,不会引起实验误差的是
A.蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定 ( )
B. 蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,而后装入一定体积的NaOH进行滴定
C. 碱式滴定管量取10.00mlNaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水进行滴定
D.用碱式滴定管量取10.00mlNaOH溶液放入用NaOH溶液过的锥形瓶中,再加入适量蒸馏水进行滴定
18.能证明HF是弱电解质的事实是
A.HF在所有卤化氢中热稳定性是最强的 B.0.5mol/L氟化钠溶液,其PH值大于7
C.浓硫酸加入氟化钠固体,有氟化氢气体产生 D.0.1mol/LHF溶液其PH=4
选择题答案:
17.对于反应:A+B=AB来说,常温时按以下情况进行反应:(1)20mL溶液中含A、B各0.01mol;(2)50mL溶液中含A、B各0.05mol;(3)0.1mol·L-1的A、B溶液各10mL混合;(4)0.5mol·L-1的A、B溶液各50mL混合。这四者反应速率的大小关系是
A.(2)>(1)>(4)>(3) B.(4)>(3)>(2)>(1) C.(1)>(2)>(4)>(3) D.(1)>(2)>(3)>(4)
16.在pH=1的无色溶液中能大量共存的离子组是
A. NH4+、Mg2+、SO42-、Cl- B.Ba2+、K+、OH-、NO3-
C. Al3+、Cu2+、SO42-、Cl- D.Na+、Ca2+、Cl-、AlO2-
15.对于弱电解质的稀溶液,温度一定时,物质的量浓度加水稀释原来的1/n时,其电离程度将增大到原来的√n倍,现有PH=2的某一元弱酸溶液10ml,加水到1L后,溶液的PH值
A.等于4 B.在3-4之间 C.等于3 D.在2-3之间
14.25℃时,PH值为4的 FeCl3溶液和PH为10的K2CO3溶液中,水的电离程度分别为a1和a2,则它们的大小关系是
A.a1> a2 B.a1 <a2 C.a1 =a2 D.无法确定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com