
题目列表(包括答案和解析)
1、苹果汁是人们喜爱的饮料,由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变为棕黄色。若榨汁时加入维生素C,可有效防止这种现象发生,这说明维生素C具有:
A、氧化性 B、还原性 C、碱性 D、酸性
14.植物对离子的选择吸收表现在:①植物对外界环境中离子的吸收具有选择性;②对同一种无机酸盐的阳离子和阴离子吸收的差异性.如我们把(NH4)2SO4称为生理酸性盐,而把NaNO3称为生理碱性盐.
(1)试从生物学上解释为什么(NH4)2SO4是生理酸性盐?
(2)在化学上(NH4)2SO4溶液呈现酸性,而NaNO3呈中性,其原因是
(3)硝酸铵的阳离子和阴离子被植物吸收时的吸收量 (填“相等”,“不相等”),所以我们称之为 盐.
13.某试剂厂用银(含杂质铜)和硝酸(含杂质Fe3+)反应制取AgNO3,步骤如下:
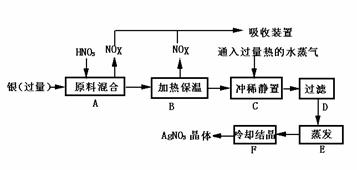
依据上述步骤,完成下列填空
(1)溶液中的硝酸应该用 硝酸(填浓或稀),原因是
a减少过程中产生NOx的量 b减小原料Ag的消耗量
c有利于硝酸充分反应,降低溶液中c(H+)
(3)步骤C是为了除去Fe3+,Cu2+等杂质,冲稀静置时发生的化学反应是
a置换反应 b水解反应 c氧化-还原反应
(4)产生的沉淀的化学式为:
12.已知A,B,C,D是中学化学中常见的四种不同微粒,它们之间存在如下关系:
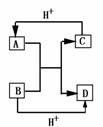
(1)如果A,B,C,D均是10电子的微粒,请写出:
A的结构式 ;D的电子式
(2)如果A和C是18电子的微粒,B和D是10电子的微粒,请写出:
①A与B在溶液中反应的离子方程式 .
②根据上述离子方程式,可以判断C与B结合质子的能力大小是(用化学式或离子符号表示) .
11.从某些方面看,氨和水相当.试回答:
(1)用简要的文字和相应的电离及化学方程式解释,为什么在液氨体系中可用NH4Cl去和NaNH2反应?
(2)氮可形成多种离子,其中N2H5+,N2H62+是由中性分子结合质子(即H+)形成的(类似NH+4),因此有类似于NH+4的性质,试写出N2H62+在强碱性溶液中反应的离子方程式 .
(3)已知40℃时四种化合物在水中和液氨中的溶解度如下:
溶解度 AgNO3 Ba(NO3)2 AgCl BaCl2
H2O(液) 170g 9.2g 1.5×10-4g 33.3g
NH3(液) 80g 97.2g 0.8g 0
上述四种物质在液氨溶液中发生复分解反应的化学方程式为 .
10.25℃时,若体积为Va,PH=a的某一元强酸与体积为Vb,PH=b的某一元强碱混合,恰好中和.且已知Va<Vb和a=0.5b,请填写下列空白:
(1)a值可否等于3(填“可”或“否”) .
其理由是 .
(2)a值可否等于5(填“可”或“否”) .
其理由是 .
(3)a的取值范围是
9.化合物SOCl2是一种液态化合物,沸点为77℃,在盛有10ml水的锥形瓶中,小心地滴加8滴-10滴SOCl2,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出.该气体可使滴有品红试液的滤纸褪色.轻轻摇动锥形瓶,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出.
(1)根据上述实验,写出SOCl2与水反应的化学方程式 .
(2)AlCl3溶液蒸干灼烧得不到无水AlCl3,而用SOCl2与AlCl3·6H2O混合共热,可得无水AlCl3,其原因是 .
8.在PH为4-5的环境中,Cu2+、Fe2+不生成沉淀而Fe3+几乎完全沉淀.工业上制CuCl2是将浓盐酸用蒸气加热到80℃左右,再慢慢加入粗氧化铜(含杂质FeO),充分搅拌使之溶解.欲除去溶液中的杂质离子,下述方法中可行的是( )
A.加入纯Cu将Fe2+还原
B.向溶液中通入H2S使Fe2+沉淀
C.在溶液中通入Cl2,再加入CuO粉未调节PH为4-5
D.在溶液中通入Cl2,再加入NH3调节PH为4-5
7.已知某温度下0.1mol/L的NaHB(强电解质)溶液中c(H+)>c(OH-),则下列关系一定正确的是( )
a+)=c(HB-)+2c(B2-)+c(OH-) a+)=0.1mol/L≥c(B2-)
C.c(H+)·c(OH-)=10-14 D.溶液的PH等于1
6.用物质的量浓度均是0.1mol/L的CH3COOH和CH3COONa配成1L溶液,c(Na+)<c(CH3COO-)下列判断正确的是( )
A.c(OH-)<c(H+) B.c(CH3COOH)+c(CH3COO-)=0.2mol/L
C.c(CH3COOH)>c(CH3COO-) D.c(CH3COO-)+c(OH-)=0.1mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com