
题目列表(包括答案和解析)
29、氢氧化钙和氯化铵各10.7g,混合后在加热条件下,使其充分反应。计算:
(1) 所得标准状况下的氨气多少升?
(2) 若将所得氨气全部溶于水制得200mL氨水,则氨水中NH3的物质的量浓度是多少?
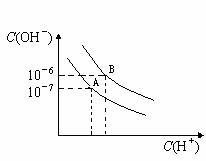
28.(10分)某金属A及其化合物之间有如下的转化关系:
根据上图回答下列问题:
(1)A、B、C的化学式分别是:A ,B ,C 。
(2)F→A的化学方程式是 。
(3)B溶液→D的离子方程式是 。
27、(6分)用实验确定某酸HA是弱电解质,甲、乙两同学的方案分别是:
甲:①称取一定质量的HA配制0.1mol/L的溶液100mL;②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量的浓度的HA溶液、盐酸。分别配制pH=1的两种酸溶液各100mL②分别取这两种溶液各10mL,加水稀释为100mL③各取相同体积的两种稀释液装入两支试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)甲同学方案中所测得溶液的PH 1(填“﹥”、“﹤”或“=”)时,才能说明HA是弱电解质。
(2)乙同学的方案中,说明HA是弱电解质的现象是 。
A.装盐酸溶液的试管中放出氢气的速率快
B. 装HA溶液的试管中放出氢气的速率快
C. 两支试管中产生气体的速率一样快
(3)请你再补充一种可以证明HA是弱电解质的方法。
26、(12分)某研究性学习小组设计了测定铝原子的相对原子质量的实验(简易装置如右图所示)。该实验主要操作步骤的顺序为:①用砂纸擦去铝条表面的氧化膜,称得质量为ag,并系于铜丝未端;②锥形瓶中加有足量的NaOH溶液,广口瓶中装有足量的水,连接好装置;③检查装置气密性;④……;⑤将温度恢复至室温,正确操作后读出量筒中水的体积为b mL。
请回答下列问题:
(1) 用手掌捂热锥形瓶,装置乙中可能会出现的现象是
(2) ④的操作是
(3) 如果铝条表面的氧化膜末除去,会导致实验结果 (填:“偏大”、“偏小”、或“不变”)。
(4) 若该实验是在101Kpa,25℃下进行的,其水蒸气的影响忽略不计,此时气体的摩尔体积约为24.0L/mol,则铝原子的相对原子质量的计算式M(Al)= (不必简化)。
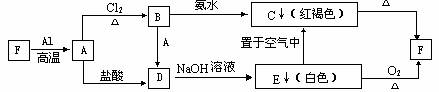
25.(5分)右图是某研究性学习小组设计的一个燃料电池的装置。请回答下列问题:
(1)a溶液是燃料电池的电解质溶液,下列物质最适宜a溶液的是 (填写a溶液的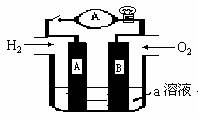 代号);
代号);
A.KOH溶液 B.蒸馏水
C. 无水乙醇 D. 液氨
(2)根据你所选择的a 溶液,写出A电极的电极反应式
24.(8分)(1)镁条在二氧化碳气体中燃烧的现象是 ,其化学反应方程式为
。
(2)向明矾溶液中逐滴加入NaOH溶液直至过量,有关反应的离子方程式为
。
23.甲、乙两烧杯中各盛有100m L3mol·L-1的盐酸和氢氧化钠溶液;向两烧杯中分别加入等质量的铝粉,反应结束时测得生成的气体体积甲︰乙=2︰3(标准状况),则加入盐酸中铝粉的质量是
A.2.7克 B. 3.6克 C. 5.04克 D. 4.05克
第二卷(非选择题 共54分)
22.0.1mol/L NaOH溶液和0.1mol/L NH4Cl溶液等体积混合后,离子浓度大小关系正确的是
A.c(Na+)>c(Cl-)>c(OH-)>c(NH4+)>c(H+)
B. c(Na+)=c(Cl-)>c(OH-)>c(NH4+)>c(H+)
C. c(Na+)=c(Cl-)>c(H+)>c(OH-)>c(NH4+)
D. c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
21.若以W1和W2分别表示浓度为a mol·L-1和b mol·L-1硝酸的质量分数,且知2a=b,则下列推断正确的是(硝酸的密度比纯水大)
A.2W1=W2 B. 2W2=W1 C. W1<W2<2W1 D. W2>2W1
20.下列各组离子在PH=1的溶液中可以大量共存的是
A.K+、Fe3+、HCO3-、SCN- B.Na+、Fe2+、I-、NO3-
C. Al3+、Na+、AlO2-、SO42- D. NH4+、Al3+、NO3-、Cl-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com