
题目列表(包括答案和解析)
22.镁带在空气中燃烧生成的固体产物主要是氧化镁和氮化镁。将燃烧后的固体产物溶解在60 mL浓度为2.0 mol/L的盐酸溶液中(氮化镁和盐酸反应的化学方程式为:Mg3N2+8HCl=3MgCl2+2NH4Cl)以20 mL 0.5 mol/L的氢氧化钠溶液中和多余的盐酸,然后在此溶液中加入过量的碱,把氨全部蒸发出来,用稀盐酸吸收,稀盐酸增重0.17 g。镁带的质量为
( )
A. 0.6 g B. 1.2 g C. 2.4 g D. 3.6 g
21.在pH=1的无色透明溶液中不能大量共存的离子组是 ( )
A. Al3+、Ag+、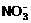 、Cl- B. Mg2+、
、Cl- B. Mg2+、 、
、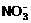 、Cl-
、Cl-
C. Mg2+、K+、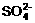 、Cl-
D. Zn2+、Na+、
、Cl-
D. Zn2+、Na+、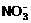 、
、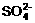
20.将pH值为8的NaOH溶液与pH值为10的NaOH溶液等体积混合后,溶液中氢离子浓度最接近于 ( )
A. 2×10-10
mol/L B. 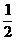 (10-8+10-10)mol/L
(10-8+10-10)mol/L
C. (10-8+10-10)mol/L D. (1×10-14-5×10-5)mol/L
19.下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是 ( )
A. 在氧化还原反应中,甲原子失去的电子比乙原子失去的电子多
B. 同价态的阳离子,甲比乙的氧化性强
C. 甲能跟稀盐酸反应放出氢气而乙不能
D. 将甲、乙作电极组成原电池时,甲是正极
18.已知[NH4Cl]≤0.1 mol/L时,溶液pH>5.1。现用0.1 mol/L盐酸滴定10 mL 0.05 mol/L氨水,用甲基橙作指示剂,达到滴定终点,所用盐酸的体积为 ( )
A. 10 mL B. 5 mL C. 大于5 mL D. 小于5 mL
17.已知工业上真空炼铷的化学方程式为:2RbCl+Mg MgCl2+2Rb(g), 对于此反应,能够进行正确解释的是
( )
MgCl2+2Rb(g), 对于此反应,能够进行正确解释的是
( )
A. Rb比Mg金属性强
B. Rb比Mg沸点低,当把铷蒸气抽走时,平衡向正反应方向移动
C. MgCl2对热的稳定性比RbCl的弱
D. 高温下,Mg2+ 得电子的能力比Rb+ 弱
16.下图是合成氨的简要流程示意图
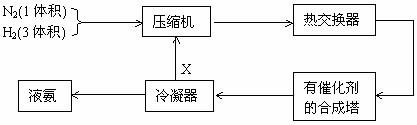
沿X路线回去的物质是 ( )
A. N2和H2 B. 催化剂 C. NH3 D. H2
15.将50 mL某未知浓度的AlCl3溶液分别加到60mL 1mol / L的NaOH溶液或60 mL 3mol / L的NaOH溶液中,均能得到1.56 g Al(OH)3沉淀。则此AlCl3溶液的浓度可能是( )
A. 1 mol / L B. 0.5 mol / L C. 0.6 mol / L D. 0.4 mol / L
14.下列叙述不正确的是 ( )
A. 两种盐溶液反应不一定能生成两种新盐
B. 白磷(P4)、晶体硅的分子构型均为正四面体
C. 同种分子的性质不一定相同,同种元素的原子的性质也不一定完全相同
D. 碱性氧化物全是金属氧化物,酸性氧化物不一定是金属氧化物
13.某溶液中有 、Mg2+、Fe2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是(MCE96.18) (
)
、Mg2+、Fe2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是(MCE96.18) (
)
A.  B. Mg2+ C. Fe2+ D. Al3+
B. Mg2+ C. Fe2+ D. Al3+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com