
题目列表(包括答案和解析)
30.某工厂用含氧化铁75%(质量分数)的赤铁矿石和一氧化碳为原料炼铁(假设杂质不参加反应).在炼铁过程中,为了使赤铁矿石充分反应,通入了过量的一氧化碳.这些过量的一氧化碳也可看成是“不参加反应的杂质”.若反应后排出的气体中一氧化碳的质量分数为10%.试计算:
(1)氧化铁(Fe2O3)的相对分子质量.
(2)该炼铁过程中所用原料赤铁矿石和一氧化碳的质量比.
(3)为了得到生铁,炼铁过程需要除去矿石中的部分杂质.如果不除去杂质,反应后所得到的产品中杂质的质量分数将会是多少?(结果可用分式表示)
答案:(1)160 (2)80∶73 (3)32.3%(或10/31)
中考链接
29.碳酸钙与氧化钙组成的混合物共100g,测得其中钙元素的质量分数为46.25%.在高温条件下煅烧此混合物,生成的气体完全被足量的澄清石灰水吸收,称得石灰水的质量增重35.2g,试计算:
(1)钙元素的相对原子质量.(精确到0.01)
(2)原混合物中碳酸钙的质量分数.(精确到0.01%)
答案:(1)39.89(2)79.91%
28.在CO和CO2的混合气体中,含氧64%,将该混合气体10g通过足量的灼热的氧化铜,使其充分反应.求:(1)共得到多少克二氧化碳?(2)有多少克氧化铜被还原?
答案:(1)13.2 g (2)16 g
可根据CO和CO2混合气体的质量、含氧百分率分别求出其中含有的CO、CO2的质量,然后分别求出CO与CuO反应时生成CCh的质量和消耗CuO的质量,从而得出要求的结果.另外,此题还可以利用反应前后C、O两种元素的质量守恒进行简便计算.
27.集满CO2的集气瓶,盖上玻璃片正立桌面,片刻后移去玻璃片,将燃着的木条放至瓶口,会看到什么现象?运用所学知识分析原因.
答案:木条继续燃烧;因为二氧化碳的密度比空气大,短时间内不会从瓶口迅速溢出.
26.向澄清石灰水中不断地通入二氧化碳气体,产生沉淀后,若继续通入CO2,会发生另外的反应,方程式为:CO2+ H2O+CaCO3=Ca(HCO3)2.若向一定质量的澄清石灰水中通入过量的二氧化碳,产生沉淀的质量(纵坐标)与通入二氧化碳的质量(横坐标)有如图6-14的关系.请回答下列问题:
(1)A点的意义: ________________________________________________________________.
(2)B点的意义:__________________________________________________________________.
(3)a与b的大小关系:____________________________________________________________.
(4)OA段发生的化学反应的方程式:________________________________________________.
答案:(1)氢氧化钙全部转变为碳酸钙 (2)碳酸钙全部转变为碳酸氢钙 (3)b=2a (4)CO2+Ca(OH)2=CaCO3↓+ H2O
二氧化碳通入澄清石灰水有浑浊现象,如果继续通入二氧化碳浑浊消失,因为二氧化碳的水溶液能溶解生成的CaCO3,其化学反应方程式是:CO2+ Ca(OH)2= CaCO3↓+ H2O,CaCO3+ H2O+CO2=Ca(HCO3)2,在解题时,不仅要考虑第一个反应,还要考虑第二个反应.从反应CO2+ Ca(OH)2= CaCO3↓+ H2O可知,参加反应的CO2与Ca(OH)2的质量比为44∶74,因为本题中CO2过量,计算沉淀质量时还要考虑第二个反应即将第一个反应中生成的碳酸钙沉淀减去第二个反应中消耗的碳酸钙的质量.
25.某学生小组对过量炭粉与氧化铁反应产物中气体的成分进行研究,装置如图6-13所示.
(1)假设:该反应的气体产物全部是二氧化碳.
(2)设计方案:将一定量氧化铁在隔绝氧气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
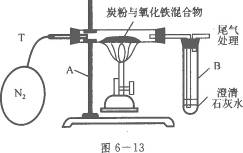
(3)查阅资料:氮气不与碳、氧化铁产生反应,可用来隔绝氧气.
(4)实验(如表6-6).
(5)数据处理:经计算,参加反应的碳元素质量为0.48g,氧元素质量为0.96g……
(6)结论:根据数据处理结果,得出原假设不成立,理由是_______________________________________________________________________________.
表6-6
|
操作步骤及实验现象 |
简 答 |
|
①称取3.2g氧化铁与2g炭粉均匀混合,放入重48.48g的玻璃管中,按图6-13装置连接 |
写出装置中编号仪器的名称:A____________________; B____________________ |
|
②加热前,先通一段时间纯净、干燥的氮气 |
其目的是____________________ |
|
③夹紧T处弹簧夹,加热一段时间,澄清石灰水变浑浊 |
该现象说明____________________ |
|
④完全反应后,冷却至室温,称得玻璃管和固体的总质量为52.24g |
|
答案:参加反应的碳元素和氧元素的质量比不为3∶8(二氧化碳中碳、氧元素的质量比) 填表:铁架台(带铁夹) 试管 排尽试管内空气 炭粉与氧化铁发生反应
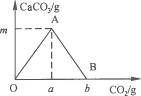
图6-14
24.某同学设计了如下实验.取四朵用石蕊试液染成的紫色的干燥纸花,分别按图6-12进行实验,请回答:
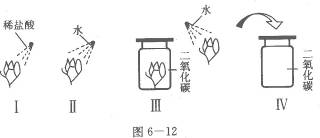
(1)观察到纸花的颜色变化是:
Ⅰ.纸花变红;Ⅱ.____________________;Ⅲ.纸花不变色;Ⅳ._______________________;
(2)该同学进行的Ⅰ、Ⅱ两实验说明了什么?__________________________________________;
(3)该同学进行四组对比实验的目的是什么?_________________________________________;
(4)写出实验Ⅳ中发生反应的化学方程式:____________________________________________.
答案:(1)紫花不变色 紫花变红色 (2)稀盐酸能使紫色石蕊试液变红而水不能 (3)证明水和二氧化碳不能使紫色石蕊试液变红,酸能使紫色石蕊试液变红,二氧化碳溶于水可以产生酸 (4)CO2+ H2O= H2CO3
23.现将N2、CO和CO2的混合气体依次通过:①澄清石灰水;②灼热的氧化铜;③澄清的石灰水;④浓硫酸(干燥剂).则第一次通过石灰水后,剩余的气体是_______________;经过浓硫酸后,剩余的气体是____________________________.
答案:N2和CO N2
22.为了使鸡蛋保鲜时间更长,有人提出了四种方法:①放入冰箱中;②放入食盐水中;③放入石灰水中;④煮熟了保存.你认为最好的方法是____________(填序号).
答案:①
21.某同学在家里做了图6-11所示的小实验,根据实验回答以下问题:
(1)图A中观察到的现象是:
①________________________;②________________________.
由此得出有关二氧化碳性质的结论是:____________________________________________,依此性质确定的一个主要用________________________________________________.
(2)当蜡烛熄灭后,在玻璃杯口迅速盖一块蘸有石灰水的玻璃片
(见图B).观察到的现象是________________________, 图6-1
有关化学方程式为________________________.根据图B中实验能否证明蜡烛中含有碳元素?为什么?
答案:(1)固体逐渐减少,有气泡产生 蜡烛熄灭 二氧化碳既不能燃烧,也不能支持燃烧,且密度比空气大 灭火 (2)石灰水变浑浊 CO2+ Ca(OH)2= CaCO3↓+ H2O 不能,因为蜡烛燃烧也可以产生二氧化碳
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com