
题目列表(包括答案和解析)
18、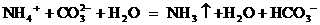
17、②①③⑧⑦⑥⑤④
16、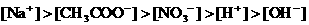
11、B 12、D 13、A 14、A.D 15、B.C
选择题提示与解答:
4题:据已知X+Y=14,氨水的POH=14-X=Y。因为氨水是弱电解质,盐酸是强电解质,所以pOH、pH相等时,氨水的物质的量浓度大于盐酸的物质的量浓度。故等体积充分混合后,氨水过量,所得溶液为NH4Cl和NH3H2O混合液,所以答案为C项。
11题:错选D:只考虑了[H+]与[OH-]相等且等体积混合,以为酸、碱完全反应了。又因溶液呈碱性以为是生成了强碱弱酸盐。没有考虑到若酸为弱酸,则弱酸的物质的量浓度比[H+]大得多。反应时酸肯定是过量的而使溶液呈酸性。故选D是错误的。据此分析,碱溶液为弱碱,与酸反应时碱过量而使溶液呈碱性,因此答案B是正确的。
15题:B、C实验的两种变量关系的正确图线分别是
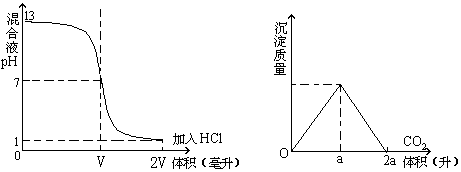
6、B 7、B 8、D 9、B 10、C.D
1、D 2、C 3、D 4、C 5、B
21、将0.05 mol/L的盐酸溶液和未知浓度的氢氧化钠溶液以1∶2的体积比混和。可得混合液的pH值为12,用上述氢氧化钠溶液滴定pH值为3的某一元弱酸溶液20毫升,达到终点时消耗氢氧化钠溶液12.5毫升,试求:
(1)氢氧化钠溶液的物质的量浓度。
(2)此一元弱酸的物质的量浓度。
(3)一元弱酸的电离度。
[答案]:
20、实验室为测定一新配的稀盐酸的准确浓度。通常用纯净的Na2CO3(无水)配成标准溶液进行滴定。具体操作是:称取W克纯净无水Na2CO3装入锥形瓶中,加适量的蒸馏水溶解。在酸式滴定管中加入待测盐酸滴定。
(1)由于CO2溶在溶液中会影响pH值,为准确滴定,终点宜选在pH值4-5之间,那么在石蕊、甲基橙、酚酞三种指示剂中应选用 。当滴定至溶液由 色变为 时,即表示到达终点。
(2)若达到滴定终点时,中和W克Na2CO3消耗盐酸V毫升,则盐酸的物质的量的浓度为 mol/L。
(3)若所称取的Na2CO3不纯,则测得盐酸的浓度就不准确。现设盐酸的准确浓度为C1 mol/L,用不纯的Na2CO3标定而测得盐酸浓度为C2 mol/L。在下述情况下,C1与C2的关系是(填“>”或“<”或“=”):
①当Na2CO3中含有NaHCO3时,则C1 C2。
②当Na2CO3中含有NaOH时,则C1 C2。
19、为了供学生课外活动,要求把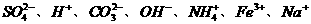 等七种离子根据离子共存原理分为两组混合溶液,每组均有阴、阳离子,且离子种类要接近。请分组结果书写如下:
等七种离子根据离子共存原理分为两组混合溶液,每组均有阴、阳离子,且离子种类要接近。请分组结果书写如下:
第一组: 。
第二组: 。
18、铵态氮肥与草木灰混合施用时,会降低氮肥的肥效,其主要原因用离子方程式表示为: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com