
题目列表(包括答案和解析)
10.为了测定呼吸作用的气体产物,某学生设计了如下装置,假定装置中的气体能够按下图中箭头所示方向稳定的运动,请回答下列问题:
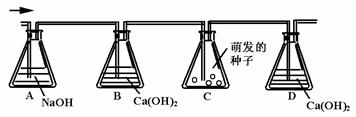
(1)A瓶内的NaOH的作用是 ,B瓶内Ca (OH)2的作用是 ,D瓶内石灰水的作用是 .
(2)如果将C瓶中的萌发的种子换成绿色植物,实验结果会怎样 ,原因是 .如果测出绿色植物吸收作用的气体产物,怎样改进实验装置 .
(3)如果将C瓶中的种子换成乳酸菌培养液,D瓶中出现的现象为 ,原因是 .
(4)如将C瓶中的种子换成酵母培养液,则D瓶中出现的现象为 ,写出C瓶中的化学反应方程式 ,若在A前面加吸收O2的装置,则D出现的现象为 ,写出C中发生的反应方程式 .
[生活实际运用]
维生素C是一种水溶性维生素(其水溶液呈酸性),它的分子式是C6H8O6,人体缺乏这种维生素易得坏血症,所以维生素C又称抗坏血酸.维生素C易被空气中的氧气氧化.在新鲜的水果、蔬菜、乳制品中都富含维生素C,如新鲜橙汁中维生素C的含量在500mg/L左右.
校课外活动小组测定了某品牌的软包装橙汁中维生素C的含量.下面是测定实验分析报告,请填写有关空白.
(1)测定目的:测定××片牌软包橙汁维生素C含量
(2)测定原理:C6H8O6+I2→C6H6O6+2H+2I-
(3)实验用品及试剂
①仪器和用品:自选
②指示剂 (填名称),浓度为7.50×10-3mol/L标准溶液,蒸馏水.
(4)实验过程:
①洗涤仪器,检查滴定管是否漏液,润洗后装好标准溶液待用.
②打开橙汁包装,用 (填仪器名称),向锥形瓶中移入20.00ml待测橙汁,滴入2滴指示剂.
③用左手控制滴定管的 (填部位),右手摇动锥形瓶,眼睛注视 直到滴定终点.滴定至终点的现象是
(5)数据记录与处理.(设计数据记录表格和数据处理的表格,不必填数据)若经数据处理,滴定中消耗标准碘溶液的体积是15.00ml,则此橙汁中维生素C的含量是 mg/L.
(6)问题讨论:
①滴定过程中能否剧烈摇动锥形瓶?为什么?
②从分析数据看,此软包装橙汁是否是纯天然橙汁? (填编号)
A.是 B.可能是 C.不是
制造商可能采取的做法是
A.加水稀释天然橙汁
B.橙汁已被浓缩
C.将维生素C作为添加剂
对上述做法,你的意见是
A.同意 B.不同意 C.调查后再作结论
[知识验证实验]
9.双指示剂法可用来测定NaOH、NaHCO3、Na2CO3中的一种或两种物质组成的混合物的含量,具体的做法是:先向待测液中加入酚酞,用标准盐酸滴定.当NaOH或Na2CO3被转化为NaCl或NaHCO3时,酚酞由红色褪为无色,消耗V1ml盐酸.然后滴加甲基橙继续用标准盐酸滴定,当NaHCO3转化为NaCl时,溶液由黄色变为橙色,又消耗V2ml盐酸.
(1)今用上法进行下表五种试样的测试,根据盐酸的用量(V1,V2)确定试样①-⑤的成分
|
试样 |
① |
② |
③ |
④ |
⑤ |
|
标准盐酸 的用量 |
V1>V2 且V2=0 |
V1<V2 且V1=0 |
V1=V2 且V2>0 |
V1>V2>0 |
V2>V1>0 |
|
试样的成分 |
|
|
|
|
|
(2)若称取含杂质的试样1.200g(杂质不与HCl反应),配制成100.00ml溶液,取出20.00ml,用0.1000mol/L标准盐酸滴定,测得V1=35.00ml,V2=5.00ml,求试样的成份及百分含量.
8.为测定固体烧碱中NaOH的质量分数C%是否在80%±2%的范围内(设烧碱中的杂质不与硫酸反应),取Wg样品配成500ml溶液,取出Vml的烧碱溶液用0.2000mol/LH2SO4标准溶液滴定,若要使到达滴定终点时,所滴入的0.2000mol/LH2SO4溶液的毫升数恰好等于C的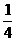 ,则:
,则:
(1)应取 毫升待测的样品溶液用于滴定.
(2)若希望取用20.00ml待测溶液用于滴定,则所称取的样品的质量W是 g.
(3)在题设条件下,若测定的固体烧碱的质量分数是80%±2%的范围内,则滴入的标准硫酸溶液的体积[可用V(H2SO4)表示]是 .
7.25℃时,物质的量浓度相等的CH3COOH和NH3·H2O的稀溶液,两者PH之和为14.
有一种并不常用的酸碱指示剂,是中性红和次甲基蓝在酒精中的混合溶液,称为“中性红-次甲基蓝混合指示剂”,它恰好能在PH=7时在溶液中呈紫蓝色,在酸性溶液中呈紫色(蓝紫),在碱性溶液中呈绿色.
(1)已知0.05mol/LNH4Cl溶液的PH=5.3,试推断0.05mol/LCH3COONa溶液的PH为 .
(2)用NaOH标准溶液(准确浓度接近0.1mol/L)测定待测的CH3COOH溶液浓度的实验方案中,试回答:
①中性红-次甲基蓝混合指示剂能否用于本实验的滴定?说明理由
②常用的酸碱指示剂中 适用于本实验的滴定.判断滴定终点的方法是 .
6.碘滴定法应该在( )
A.强酸性溶液中进行 B.强碱性溶液中进行
C.接近中性溶液中进行 D.上述三种溶液的环境中均可以
5.在碘滴定法中,常用的指示剂是( )
A.淀粉 B.甲基橙 C.酚酞 D.石蕊
4.化学上鉴定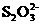 的方法之一是使用AgNO3溶液作试剂.将AgNO3溶液逐渐滴入含有S2O2-3的溶液中时会有以下反应发生:Ag++2
的方法之一是使用AgNO3溶液作试剂.将AgNO3溶液逐渐滴入含有S2O2-3的溶液中时会有以下反应发生:Ag++2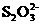 =[Ag(S2O3)2]3- 3Ag++[Ag(S2O3)2]3-=2Ag2S2O3↓(白)
Ag2S2O3+H2O=Ag2S↓(黑)+H2SO4对于鉴定S2O2-3的下列叙述不正确的是( )
=[Ag(S2O3)2]3- 3Ag++[Ag(S2O3)2]3-=2Ag2S2O3↓(白)
Ag2S2O3+H2O=Ag2S↓(黑)+H2SO4对于鉴定S2O2-3的下列叙述不正确的是( )
A.该鉴定可在酸性或碱性溶液中进行
B.该鉴定只能在中性溶液中进行
C.AgNO3必须过量
D.S2-对该鉴定有干扰
碘滴定法是以硫代硫酸钠为标准溶液来滴定溶液中的I2(或溶解的I2,或由反应生成的I2),以测定待测液一些物质的含量的方法,离子方程式为I2+2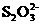 =2I-+
=2I-+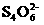 ,根据以上叙述,结合所学知识,回答5-6题
,根据以上叙述,结合所学知识,回答5-6题
3.五氟化碘(IF5)是重要的卤氟化物,其化学分析法的原理是:利用IF5与水反应生成碘酸和氟化氢(IF5+3H2O=HIO3+5HF),生成的碘酸在弱酸性溶液中与KI反应生成游离碘(IO-3+5I-+6H+=3I2+3H2O)用标准硫代硫酸钠溶液滴定碘(2Na2S2O3+I2=Na2S4O6+2NaI),若已知滴定耗用硫代硫酸钠的物质的量为0.3mol,则分析的试样中IF5的物质的量为( )
A.0.3mol B.0.2mol C.0.1mol D.0.05mol
2.将Cl2通入0.05mol/LH2S溶液中,刚好硫全部析出,此时溶液的PH为( )
A.0.1 B.3 C.2 D.1
1.如图为10ml一定物质的量浓度的盐酸X,用一定浓度的NaOH溶液Y滴定的图示.依据图示,推出X和Y的物质的量浓度是( )
|
|
A |
B |
C |
D |
|
X的物质的量浓度(mol/L) |
0.12 |
0.04 |
0.03 |
0.09 |
|
Y的物质的量浓度(mol/L) |
0.04 |
0.12 |
0.09 |
0.03 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com