
题目列表(包括答案和解析)
3.下列各溶液中的PH相同时,物质的量浓度最大的是:( )
A.NH3·H2O B.NaOH C.KOH D.Ba(OH)2
2.在25℃时,0.1mol/L的硫酸中,水的KW值为( )
A.大于1×10-14 B.小于1×10-14
C.等于1×10-14 D.无法确定
1.往纯水中加入下列物质,能使水的电离平衡发生移动的是( )
A.NaCl B.NaOH C.酒精 D.CH3COOH
2.在计算PH=11的NaOH和PH=13的NaOH溶液等体积混合时,以下算法为什么不对?
c(H+)=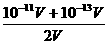 PH=-lg{c(H+)}
PH=-lg{c(H+)}
解释:因为在碱溶液中,溶质是OH-离子,而不是H+离子,因此要抓住矛盾的主要方面,即溶液中的溶质来计算物质的量浓度,因此正确的计算方法是:先计算混合后溶液中OH-的浓度
c(OH-)=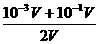
再由水的离子积求c(H+),最后求PH
c(H+)=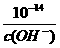 ,PH=-lg{
,PH=-lg{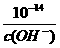 }
}
[难题巧解点拨]
例1:常温下,某溶液中由水电离产生的c(H+)=1×10-11mol/L,则该溶液的PH可能是( )
A.3 B.7 C.8 D.11
解析:根据水的电离平衡 H2O H++OH-知:由水电离产生的c(H+)=c(OH-)=1×10-11mol/L,抑制水电离的原因是溶液中H+浓度或OH-浓度增大,若由于H+的浓度增大,则该溶液中c(H+)=
H++OH-知:由水电离产生的c(H+)=c(OH-)=1×10-11mol/L,抑制水电离的原因是溶液中H+浓度或OH-浓度增大,若由于H+的浓度增大,则该溶液中c(H+)=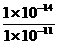 =1×10-3mol/L,即PH=3;若是由于OH-浓度增大,则该溶液中c(OH-)=
=1×10-3mol/L,即PH=3;若是由于OH-浓度增大,则该溶液中c(OH-)=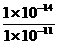 =1×10-3mol/L,即PH=11,故选A、D
=1×10-3mol/L,即PH=11,故选A、D
答案:A,D
例2 在80℃时,纯水的PH小于7,其原因是什么?
分析:已知室温时,纯水的c(H+)=c(OH-)=10-7mol/L,又因水的电离:H2O H++OH-是吸热反应,故温度升高到80℃,水的电离平衡右移,致使c(H+)=c(OH-)>10-7mol/L,即PH<7.
H++OH-是吸热反应,故温度升高到80℃,水的电离平衡右移,致使c(H+)=c(OH-)>10-7mol/L,即PH<7.
例3:将PH为3和PH为5的稀盐酸等体积相混合,所得溶液的PH为( )
A.3.7 B.3.3 C.4.7 D.5.3
分析:PH=3的盐酸 c(H+)=10-3mol/L
PH=5的盐酸中c(H+)=10-5mol/L,等体积混合后
c(H+)=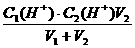
=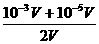 =5.05×10-4mol/l
=5.05×10-4mol/l
PH=-lg5.05×10-4=4-0.7=3.3
此题也可用经验公式验算:(1)若两强酸PH之差≥2,则等体积混合后溶液的PH=PH较小的+0.3.
(2)若两强碱PH之差≥2,则等体积混合后溶液的PH=PH较大的-0.3.
答案:B
[典型热点考题]
例1:有一学生在实验室测某溶液的PH,实验时,他先用蒸馏水润湿PH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测.
(1)该生的操作方法是否正确?
(2)如不正确请说明理由,同时请分析是否一定有误差产生.
(3)若用此法分别测定c(H+)相等的H3PO4和H2SO4溶液的PH,结果会怎样?
分析:(1)不正确.
(2)若溶液不显中性,则H+或OH-被稀释,测出的不为溶液中H+或OH-对应的PH;当溶液为中性时则不会产生误差.
(3)测得的H3PO4的PH较H2SO4小,因为在稀释过程中,H3PO4继续电离产生H+,使得该溶液中c(H+)较H2SO4溶液中c(H+)大.
例2:能使水的电离平衡:H2O+H2O H3O++OH-发生向电离的方向移动,且使溶液呈酸性的是( )
H3O++OH-发生向电离的方向移动,且使溶液呈酸性的是( )
A.在水中加KHCO3 B.在水中加HCl
C.在水中加CuCl2 D.将水加热至100℃
分析:根据题意的要求进行判断
A不符合题意.因为加入KHCO3后,会发生反应HCO-3+H+ H2CO3,消耗H+,使水的电离平衡向电离的方向移动.但c(H+)不断减小,c(OH-)不断增大,使得c(OH-)>c(H+),故溶液显碱性,不显酸性.
H2CO3,消耗H+,使水的电离平衡向电离的方向移动.但c(H+)不断减小,c(OH-)不断增大,使得c(OH-)>c(H+),故溶液显碱性,不显酸性.
B不符合题意,因为加入HCl后,增大了c(H+)平衡左移,不符合题意.
C符合题意,加入CuCl2后,会发生反应Cu2++2OH-=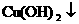 ,消耗了OH-,使水的电离平衡右移且c(OH-)不断减小,c(H+)则不断增大,结果c(H+)>c(OH-)溶液呈酸性,符合题意.
,消耗了OH-,使水的电离平衡右移且c(OH-)不断减小,c(H+)则不断增大,结果c(H+)>c(OH-)溶液呈酸性,符合题意.
D不符合题意,温度升高、水的电离平衡虽然右移,但水中c(H+)和c(OH-)都同时增大,且始终相等不能呈酸性.
答案:C
例3:25℃时,将某强酸或某强碱溶液按1∶10的体积比混合后溶液恰好呈现中性,则混合前此强碱与强酸溶液的PH之和是 .
分析:混合前强酸PH=a,强碱PH=b,则C酸(H+)=10-amol/L C碱(H+)=10-bmol/L
C碱(OH-)=10b-14mol/L 依题意:n(H+)=n(OH-)
则有:10-a×1=10b-14×10 化简得:a+b=13
答案:13

[同步达纲练习]
1.酸性溶液中只有H+,碱性溶液中只有OH-.这句话对吗?为什么?
解析:不对,因为任何水溶液中都存在水的电离平衡,故不管是酸性、碱性,还是中性溶液,H+和OH-都存在,它们作为矛盾的双方,既互相依存,又互相制约,共同决定了溶液的酸碱性,在酸性溶液中不是没有OH-,只是c(H+)>c(OH-);在碱性溶液中也不是没有H+,而是c(OH-)>c(H+);在中性溶液中c(OH-)=c(H+).
2.有关PH的简单计算
(1)强酸:PH=-lg{c(H+)}
(2)强碱:PH=-lg{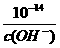 }
}
(3)两强酸相混合:c(H+)=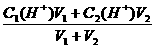
(4)两强碱相混合:c(OH-)=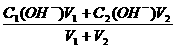
(5)强酸强碱混合:
若恰好反应则:C1(H+)V1=C2(OH-)V2
若酸过量则:c(H+)=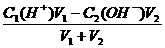
若碱过量则:c(OH-)=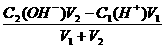
[重点难点解析]
重点:
①水的电离、水的离子积;②C(H+):PH与溶液酸碱性的关系
难点:①水的离子积的概念;②有关PH值的计算.
1.纯水中存在如下平衡:H2O H++OH--Q,当改变条件时,填写表中各项内容.
H++OH--Q,当改变条件时,填写表中各项内容.
|
改变条件 |
平衡移动方向 |
PH |
水电离出的c(H+) |
KW |
|
升温 |
→右移 |
减小 |
增大 |
变大 |
|
通入HCl气体 |
←左移 |
减小 |
减小 |
不变 |
|
加入NaOH固体 |
←左移 |
增大 |
减小 |
变大 |
|
加入NH4Cl固体 |
→右移 |
减小 |
增大 |
不变 |
|
加入金属钠 |
→右移 |
增大 |
增大 |
不变 |
3.实验室中常用中和滴定、氧化还原滴定等方法测定未知浓度的某反应物的物质的量浓度或测定某样品的纯度
(1)请回答下列关于指示剂的选用问题:
①用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,应选择 作指示剂.
②用已知浓度的盐酸滴定未知浓度的碳酸钠溶液且最终生成二氧化碳时,应选择 作指示剂.
③用已知浓度的硫代硫酸钠滴定未知浓度的碘水时,应选择
作指示剂.(有关反应的化学方程式为2Na2S2O3+I2 Na2S4O6+2NaI)
Na2S4O6+2NaI)
④用已知浓度的高锰酸钾溶液滴定未知浓度的硫酸亚铁酸性溶液时应 指示剂,原因是 .
(2)用已知浓度的盐酸滴定未知浓度的稀氢氧化钠溶液时,为减小滴定误差,在选用盐酸的物质的量浓度和体积时,下列四个选项中最佳的是 (填选项字母).
A.1mol·L-1、50ml B.0.2mol·L-1、25ml
C.0.02mol·L-1、5ml D.5mol·L-1、5ml
(3)已知基准物是某些纯度高、稳定性好的物质.可在准确称量其质量后直接配成标准溶液并标定溶液浓度.现有用浓盐酸新配制出的标准溶液,由于 (填写原因)使得浓度不很精确.该盐酸在使用前,需用基准物进行标定.实验室标定标准的盐酸一般选用纯净的无水碳酸钠作基准物.
①上述基准物能否改用纯净的氢氧化钠固体 (“能”或“不能”);简述理由
②某学生误将一种不纯的碳酸钠样品作基准物,则所测得的盐酸浓度将 (填偏高、偏低、无法确定、不受影响).
2.利用课外活动测定水果中维生素C的含量.
1.可组织学生到附近的化肥厂参观,观察检验科是怎样测定化肥中某元素的含量的,让学生了解定量分析实验在生产,生活中的运用.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com