
题目列表(包括答案和解析)
23.向VmlBaCl2溶液中加入一定体积的0.05mol/LH2SO4溶液,两者恰好完全反应,且反应后溶液的PH为3.0,原BaCl2的物质的量浓度为( )
A.5.05×10-4mol/L B.5.05×10-3mol/L
C.1.01×10-4mol/L D.1.01×10-3mol/L
22.将PH为5的H2SO4溶液稀释500倍,稀释后溶液中c(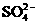 )和c(H+)之比约为( )
)和c(H+)之比约为( )
A.1∶1 B.1∶2 C.1∶10 D.10∶1
21.由重水D2O组成的水,D2O的离子积为1.6×10-15,可用PH一样定义规定PD=-lg{c(D+)},下列关于PD的叙述,正确的是( )
A.D2O呈中性,PD=7
B.1LD2O溶液中含0.01molNaOD,PD=12
C.用D2O溶解0.1molDCl成1L溶液,PD=2
D.在100ml0.25mol/LDCl溶液中加入50ml0.2mol/L的NaOD的D2O溶液,PD=1
20.化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂
HIn (溶液)  H+(溶液)+ In-(溶液)
H+(溶液)+ In-(溶液)
红色 黄色
浓度为0.02mol/L的下列各溶液:(1)盐酸, (2)石灰水 (3)NaCl溶液 (4)NaHCO3溶液 (5)氨水
其中能使指示剂显红色的
A.(1)(4)(5) B.(2)(5)(6) C.(1)(4) D.(2)(3)(6)
19.在室温下,某溶液中由水电离出的c(H+)为1×10-13mol/L,则此溶液中一定不可能大量存在的离子组是( )
A.Fe3+、 、Cl-、Na+ B.Ca2+、
、Cl-、Na+ B.Ca2+、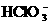 、
、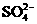 、
、
C.  、Fe2+、
、Fe2+、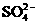 、
、 D.Cl-、
D.Cl-、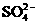 、K+、Na+
、K+、Na+
18.与纯水的电离相似,液氨中存在着微弱的电离,2NH3 NH+4+NH-2,据此在以下叙述中错误的是( )
NH+4+NH-2,据此在以下叙述中错误的是( )
A.液氨中含有NH3、NH+4、NH-2等微粒
B.一定温度下c(NH+4)与c(NH-2)的乘积为一定值
C.液氨的电离达平衡时,液氨中c(NH+4)=c(NH-2)
D.不加入其它物质,液氨中c(NH+4)=c(NH2-)
17.常温下,A溶液的PH=4,B溶液中的c(OH-)=1×10-12mol/L,C溶液中的c(H+)=1×10-3mol/L,D溶液中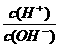 =1×104,则此四种溶液的酸性由强到弱的顺序为( )
=1×104,则此四种溶液的酸性由强到弱的顺序为( )
A.DACB B.BCAD C.CADB D.ABCD
16.水是一种极弱的电解质,在室温下每n个水分子中只有1个分子发生电离,则n值是( )
A.107 B.55.6×107 C.1×10-14 D.55.6
15.90℃时,水的离子积KW=3.8×10-13,则此温度时纯水的PH是( )
A.等于7 B.大于7 C.小于7 D.等于8
14.将PH相同的醋酸和硫酸,分别用蒸馏水稀释至原溶液体积的a倍和b倍,稀释后两溶液的PH仍相等,则a和b的关系是( )
A.a>b B.a=b C.a<b D.无法确定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com