
题目列表(包括答案和解析)
17.已知铅蓄电池放电时发生如下反应:
负极:Pb-2e-+SO42-=PbSO4 正极:PbO2+2e-+4H++SO42-=PbSO4+2H2O
若电池在放电过程中有1mol的硫酸消耗,则该电池对外提供的电量为(已知1mol电子的电量为9.648X104C)
A.9.648X104C B.1.930x104C C.4.824X104C D.1.930X105C
16.把一块镁铝合金溶于足量的盐酸中,再加入过量的氢氧化钠溶液,过滤,把滤渣充分灼烧,得到的固体残留物恰好跟原来合金的质量相等,则此合金中镁、铝质量之比为
A. 1:1 B. 3:2 C. 7:3 D. 1:4
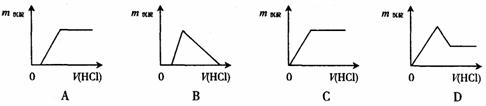
15.向含有少量氢氧化钠的偏铝酸钠溶液中逐滴加入盐酸至过量,能正确表示这一过程的曲线图是(图中纵坐标表示沉淀的质量,横坐标表示加入盐酸的体积)
14.下列各组物质中,将前者加入后者时,无论前者是否过量,都能用同一个化学方程式表示的是
A、铜,氯化铁溶液 B、二氧化碳,澄清石灰水
C、稀盐酸,碳酸钠溶液 D、氢氧化钾溶液,氯化铝溶液
13.在t℃时,向一个被活塞密封的恒压容器中放人1molX气体和1molY气体,发生下列反应:X(g)+Y(g)  Q(g)+2R(g),平衡时R的含量为w%。其它条件不变,按下列配比将气体放人容器中,达到平衡时,R的含量不等于w%的是
Q(g)+2R(g),平衡时R的含量为w%。其它条件不变,按下列配比将气体放人容器中,达到平衡时,R的含量不等于w%的是
A.2molX和 2molY B.1molX、1molY和1molQ
C.1molQ和2molR D.2molR和Q、X、Y各1mol
12.下列各组物质充分混合后,滴入KSCN溶液显红色的是
A.FeO+HCI(溶液) B.过量铁+稀硝酸
C.铁+硫酸铜溶液 D.Fe(NO3)2+盐酸
11.将10 mL0.1 mol·L-1氨水与10 mL0.2 mol·L-1盐酸混合后,溶液中各种离子的物质的量浓度由大到小的顺序是
A. c(Cl-)>c(H+)>c(NH4+)>c(OH-) B. c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.c(NH4+)>C(Cl-)>c(OH-)>c(H+) D.c(H+)>c(Cl-)>c(NH4+)>c(OH-)
10.一定温度下,向0.1mol·L-1氨水中加入氯化铵晶体,则溶液中随着氯化铵晶体加入而变小的是
A.c(H+) B.c(H+)·c(OH-) C.c(OH-)/c(NH3·H2O) D.c(NH4+)/c(OH-)
9.四位同学同时进行A+3B=2C+2D的反应速率测定实验,分别测得反应速率如下:①v(A)=0.15mol/(L·s);v(B)=0.6mol/(L·s);v(C)=0.4mol/(L·s);v(D)=0.45mol/(L·s)。其中,反应进行得最快的是
A.① B.② C.③ D.④
8.a、b、c都是金属,a中混有c时,a先腐蚀;a与b组成原电池时,a为电池的正极。a、b、c三种金属的活动性顺序为
A.a>b>c B.b>a>c C.a>c>b D.b>c>a
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com