
题目列表(包括答案和解析)
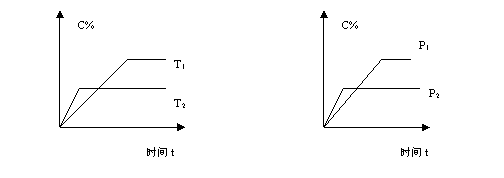
5.可逆反应:Ma(s)+Nb(g) eC(g)+ fD(g),当其它条件不变时,C的百分含量C%与温
eC(g)+ fD(g),当其它条件不变时,C的百分含量C%与温
度(T)和压强(P)的关系如右图所示。下列叙述正确的是
A.T1<T2,正反应是吸热反应. B.P1<P2,n<e+f
C.P1>P2,m+n>e+f D.达到平衡后,增加A的量有利于平衡向正反应方向移动。
4.室温下,浓度为0.1mol/L-1HA、HB、HC、HD四种一元酸,已知HA溶液中c(H+)=0.1mol/L-1,电离常数K(HC)<K(HB)<K(HD)。四种酸对应的钠盐,在同温同浓度的条件下,从pH大到小的顺序为
A.NaA>NaB>NaC>NaD B.NaB>NaC>NaA>NaD
C.NaD>NaA>NaC>NaB D.NaC>NaB>NaD>NaA
3.一种化学冰袋含有Na2SO4·10H2O(96g)、NH4NO3(50g)、(NH4)2SO4(40g)、NaHSO4(40g)将和其它三种盐分别放在二只塑料袋中,同时把它们混合并用手搓揉就可致冷,致冷效果能维持2-3小时。以下关于致冷原因的推测肯定错误的是
A.脱水是吸热过程
B.较长时间致冷是由于脱水过程较慢
C.铵盐在该条件下发生的是复分解反应会吸收热量
D.溶于结晶水中会吸收热量
2.第二次世界大战期间,某国侦察小分队到德国法西斯一座十分隐蔽且又戒备森严的军火厂,上级要求小分队在三天内必须炸毁它,结果他们用十多只涂有化学药剂的老鼠完成了任务。据你推测这种药剂是
A.黑火药和酒精 B.白磷和二硫化碳溶液
C.高锰酸钾和硫酸 D.硝酸铵和水
1.1998年诺贝尔化学奖授予科恩(美)和波普尔(英),以表彰他们在理论化学领域作出的重大贡献。他们的工作使实验和理论能够共同协力探讨分子体系的性质,引起整个化学领域正在经历一场革命性的变化。下列说法正确的是
A.化学不再是纯实验科学 B.化学不再需要实验
C.化学不做实验,就什么都不知道 D.未来化学的方向还是经验化
34.(7分)为了测定含SiO2杂质的赤铁矿中铁的含量,称取11.2 g该样品的粉末,放人到50mL3.8mol/L硫酸中充分反应,再加入4.48g铁粉,反应完全后放出气体672mL(标准状况),最后溶液中留下白色沉淀。滤出沉淀后将滤液稀释至200mL,溶液呈强酸性。假设赤铁矿中只含氧化铁和二氧化硅,试计算:
(1)铁矿石中铁的质量分数;(2)最后所得200mL溶液的pH。
33.(6分)将3molA气体与2
molB气体在2 L容器中混合并在一定条件下发生如下反应:2A(g) + B(g) 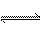 2C(g)。达到平衡后测得容器内压强减小了28%,试计算:
2C(g)。达到平衡后测得容器内压强减小了28%,试计算:
(1)C的物质的量浓度;(2)A、B的转化率。
32.(9分)无水氯化铝是白色晶体,易吸收水分,在178℃时升华。装有无水氯化铝的试剂瓶久置于潮湿的空气中,会自动爆炸并产生大量白雾。某课外兴趣小组在实验室设计了如下图所示装置制取少量纯净的无水氯化铝。
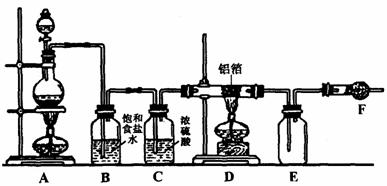
试回答下列问题:
(1)实验时A装置的分液漏斗中装的物质是 ,E中的白色固体化学式是 。
(2)写出A、D中发生反应的化学方程式:A ,D 。
(3)F中应填充的固体物质是 。其作用是 。
(4)从A装置中导出的气体,若不经过B、C装置而直接进入D管,可能对实验产生的不良后果是 。
31.(8分)某学生用0.1mol/L的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
a.移取20mL待测盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞试液
b.用标准溶液润洗滴定管2 -
-


 3次
3次
c.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
d.取标准KOH溶液注入碱式滴定管至刻度“0”以上2 cm-3 cm处
e.调节液面至“0”或“0”以下某一刻度,记下读数
f.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度就此实验回答下列问题:
(1)正确操作步骤的顺序是(填序号字母) 。判断到达滴定终点的现象是 。
(2)上述a步操作之前,若先用待测溶液润洗锥形瓶,则使测定结果 (填“偏高”、“偏低”、“不受影响”。下同)。
(3)若称取的KOH固体中含少量NaOH,用此固体配制的标准溶液来滴定上述盐酸,则会使测定结果 。
30.(6分)在一定条件下,下列各物质之间可实现如图所示转化,部分生成物已略去。
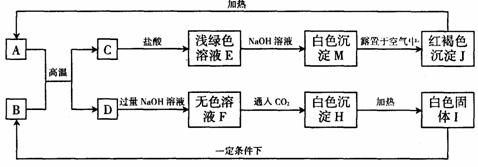
(1)A、B、E、H四种物质的化学式是:A ,B ,E ,H 。
(2)写出反应M→J的化学方程式 。
(3)写出D中加入过量NaOH溶液时发生反应的离子方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com