
题目列表(包括答案和解析)
2.物质的量浓度都为0.1 mol/L的下列溶液中,pH最小的是
A.NH4Cl B.NaCl
C.CH3COONa D.NaNO3
1.下列说法正确的是
A.强电解质一定是离子化合物
B.强电解质、弱电解质的电离都是吸热过程
C.强电解质的饱和溶液一定是浓溶液
D.强电解质在水中一定能全部溶解
25.(10分)维生素C是一种水溶性维生素(是水溶液呈酸性),它的分子式是C6H8O6,人体缺乏这种维生素易得坏血症,所以维生素C又称抗坏血酸.维生素C易被空气中的氧气氧化. 在新鲜的水果,蔬菜,乳制品中都富含维生素C,如新鲜橙汁中维生素C的含量在500mg·L-1左右.
校课外活动小组测定了某品牌的软包装橙汁中维生素C的含量.下面是测定实验分析报告,请 填写有关空白.
(1)测定目的:测定××品牌软包橙汁维生素C含量
(2)测定原理:C6H8O6+I2?C6H6O6+2H++2I-
(3)实验用品及试剂
①仪器和用品:自选
②指示剂 (填名称),浓度为7.50×?10-3mol·L-1标准溶液,蒸馏水.
(4)实验过程:
①洗涤仪器,检查滴定管是否漏液,润洗后装好标准溶液待用.
②打开橙汁包装,用 (填仪器名称),向锥形瓶中移入20.00ml待测橙汁,滴入2滴指 示剂.
③用左手控制滴定管的 (填部位),右手摇动锥形瓶,眼睛注视 直到滴定终点,滴定至终点的现象是
(5)数据记录与处理.(设计数据记录表格和数据处理的表格,不必填数据)若经数据处理,滴 定中消耗标准碘溶液的体积是15.00ml,则此橙汁中维生素C的含量是 mg·L-1 .
(6)问题讨论:
①滴定过程中能否剧烈摇动锥形瓶?为什么?
②从分析数据看,此软包装橙汁是否是纯天然橙汁? (填编号)
A.是 B.可能是 C.不是
制造商可能采取的做法是
A.加水稀释天然橙汁
B.橙汁已被浓缩
C.将维生素C作为添加剂
对上述做法,你的意见是
A. A. 同意 B.不同意 C.调查后再作结论
回答23-24题的问题.
23.(5分)为了测定从湖底取出的水样中SO2的含量,可在一定的水样中加入一定量的碘(过 量),再用已知浓度的硫代硫酸钠溶液滴定过量的碘,该反应为:2Na2S2O3+I2=2Na I+Na2S4O6
(1)碘和水样中SO2反应的化学方程式为: .
(2)用硫代硫酸钠滴定过量的碘时,应选用 作指示剂,当溶液 (填现象)便达到滴定终点.
(1) (1) 若在20ml水样中加入碘Wg,用去Vml cmol·L-1的Na2S2O3溶液,则水样中SO2的浓度
为 mol·L-1.
24.(5分)为了测定从湖底抽出的有毒气体中CO2的含量,需将CO2变成沉淀,然后测其质量,通过计算求出CO2的含量,从图中选择必要的装置(导管和胶管省略)设计实验,将CO2转变成沉淀.
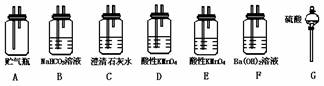
(1)其所选装置的连接顺序是(按从上到下从左至右的顺序) .
(2)将气体两次通过酸性高锰酸钾溶液的目的是 .
(3)是否需要选择装置B?为什么 .
(4)为了测得沉淀物的质量,还需进行的操作有 ;还需要的仪器有 .
22.(7分)用已知浓度的盐酸滴定未知浓度的氢氧化钾溶液,滴定过程中进行如下操作,分别 指出各项的操作对测定结果的影响(可用“偏高”、“偏低”、“无影响”).
(1)滴定前,滴定管尖咀处有气泡,滴定后气泡消失. .
(2)滴定管经蒸馏水洗涤后,即装入标准溶液进行滴定. .
(3)滴定前,锥形瓶用蒸馏水洗涤后,未用待测的氢氧化钾溶液润洗就做滴定. .
(4)用移液管量取待测液后,又用蒸馏水洗涤移液管,并将洗涤液一起注入锥形瓶中. .
(5)滴定过程中由于振荡过于剧烈,使少量溶液溅出锥形瓶外. .
(6)滴定管读数时,用俯视记终点. .
(7)滴定完毕后,在滴定管尖咀外留有液滴. .
喀麦隆的“杀人湖”(尼奥斯湖)曾于1986年使1800名附近居民在一夜之间神秘死去 ,后经科学家考察发现,湖底有火山口,聚集了大量二氧化碳和二氧化硫等气体,并发现在 200m深的湖底每m3湖水竟溶解了8m3的有毒气体.目前科技人员已找到一种有效的办法将 湖底有毒气体抽出并加以处理.
21.(6分)含有一定量CH3COONa和CH3COOH的水溶液称为“缓冲溶液”,在此溶液中加入少量的强碱或强酸时,溶液的PH值几乎不变,这可由下列离子方程式来说明:
加酸时:CH3COO-+H+=CH3COOH
加碱时:CH3COOH+OH-=CH3COO-+H2O 由于CH3COOH和CH3COO-的大量存在,加少量酸或碱时,溶液中[H+]与[OH-] 基本保持不变.
(1)含有一定量NaH2PO4和Na2HPO4的溶液,也具有缓冲作用,写出此溶液中加入酸或碱时发生的离子反应方程式:
加酸时 ;
加碱时 .
(2)请举出可形成缓冲溶液的一组物质: 和 .
20.(6分)某盐的化学式XmYn为最简结构(m≠n),将一定量的该盐溶于足量水时:
(1)若测得溶液的PH为5,则该盐与水反应的离子方程式可能为 .
(2)若测得该盐溶液的PH为9,则该盐与水反应的离子方程式可能为 .
(3)若x、y为同周期的短周期元素,XmYm溶于水时,既有白色沉淀产生,又有无色气体 放出,则XmYm溶于水的化学方程式为 .
19.近年来,某些自来水厂在用液氯进行消毒处理时还加入少量液氨,其反应的化学方程式
为:NH3+HClO H2O+NH2Cl(一氯氨),NH2Cl较HClO稳定.试分析加液氨能延长液氯杀菌时间的原因.
H2O+NH2Cl(一氯氨),NH2Cl较HClO稳定.试分析加液氨能延长液氯杀菌时间的原因.
18.已知醋酸铵溶液约为中性,又知醋酸加入碳酸钠溶液中有气体放出,试推断碳酸氢铵溶液的PH是大于、小于还是等于7?
17.pH值相同的醋酸和盐酸,分别用蒸馏水稀释到原来体积的m倍和n倍,稀释后两溶液的pH 值仍相同,则m和n的关系是( )
A.m>n B.m=n C.m<n D.不能确定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com