
题目列表(包括答案和解析)
1、设电解后溶液中含NaOH x mol、H2O y mol,则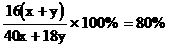 。解得:x∶y = 1∶10。电解方程式为:2NaCl + 2H2O
。解得:x∶y = 1∶10。电解方程式为:2NaCl + 2H2O 2NaOH + H2
2NaOH + H2 +Cl2
+Cl2 ,可知电解前原溶液中含NaCl x mol,含H2O(x + y)mol。当x = 1、y = 10时,
,可知电解前原溶液中含NaCl x mol,含H2O(x + y)mol。当x = 1、y = 10时,
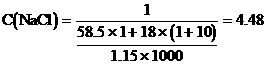
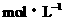 。
。
19、如果误差为0.1%,即多滴了0.1mL NaOH,混合液中
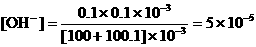 ,
,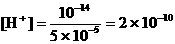 ,pH = 9.7;
,pH = 9.7;
如果误差为-0.1%,即少滴入了0.1mL NaOH,混合液中
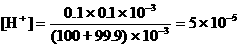 , pH = 4.3。
, pH = 4.3。
18、NaHCO3:pH = 8.4,[H+]1=10-8.4,[OH-]1=10-5.6;Na2CO3:pH = 11.4,
[H+]2=10 -11.4,[OH-]2=10-2.6,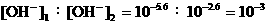 。
。
14、铅蓄电池的总反应式为:Pb + PbO + 2H2SO4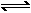 2PbSO4+2H2O。电解NaCl饱和溶液时,电路上有2 mol电子通过时消耗2 mol的H2SO4,此时在阳极应产生1 mol Cl2。若要制得0.050mol Cl2,需消耗H2SO4为0.10 mol。
2PbSO4+2H2O。电解NaCl饱和溶液时,电路上有2 mol电子通过时消耗2 mol的H2SO4,此时在阳极应产生1 mol Cl2。若要制得0.050mol Cl2,需消耗H2SO4为0.10 mol。
11、电解时阴极增重,说明有金属析出,则电解方程式为:
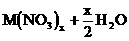

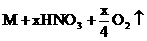 。设金属M的摩尔质量为M,则:
。设金属M的摩尔质量为M,则:
M--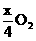
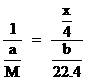 解得:
解得: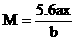
10、放电时该装置作为原电池,氢元素由0价升高为+1价,H2是负极,H原子失电子变成H+离子,负极周围溶液的pH不断减小。镍元素由+3价降低为+2价,镍元素被还原。因此A、B不正确,D正确。充电时该装置作为电解池,氢元素由+1价降低为0价,氢元素被还原。C正确。
7、①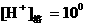
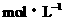 ,
,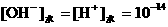
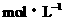 ;
;
②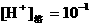
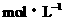 ,
, 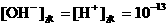
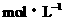
③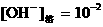
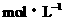 ,
,
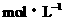
④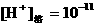
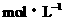 ,
,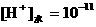
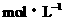
①∶②∶③∶④ 。
。
2、0.1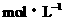 、0.2
、0.2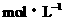 。
。
部分习题解析:
3、(1)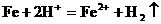
(2)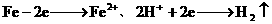 、增大。
、增大。
(3)Zn、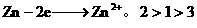 。
。
2、(1)冰醋酸未发生电离反应,无自由移动的离子。
(2)b < a < c。
(3)C
(4)①加NaOH 固体、②加CH3·COONa固体、③加活泼金属。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com