
题目列表(包括答案和解析)
18.某酸的酸式盐NaHY在水溶液中,HY-的电离程度小于HY-的水解程度。有关叙述中正确的是
A.H2Y在电离时为:H2Y+H2O HY-+H3O+
HY-+H3O+
B.在该盐的溶液中,离子浓度为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
C.在该盐的溶液中,离子浓度为:c(Na+)>c(HY-)>c(Y2-)>c(OH-)>c(H+)
D.HY-水解方程式为:HY-+H2O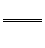 Y2-+H3O+
Y2-+H3O+
高二化学期中试卷
第Ⅰ卷(选择题,共72分)
17.在由水电离出的c(H+)=1×10-13mol/L的溶液中,一定不能大量共存的是
A.SO42-、Na+、K+、AlO2- B.Fe2+、K+、NO3-、MnO4-
C.Al3+、NO3-、Ba2+、Cl- D.H2PO4-、NH4+、Ag+、NO3-
16.下列事实①NaHCO3溶液呈碱性 ②NaHSO4溶液呈酸性 ③长期使用化肥(NH4)2SO4会使土壤酸性增大,发生板结 ④加热能增加纯碱的去污能力 ⑤配制CuCl2溶液,用稀盐酸溶解CuCl2固体 ⑥明矾能净水 ⑦氯化铵溶液可作焊药去除金属制品表面的锈斑 ⑧加热FeCl3·6H2O晶体,往往得不到FeCl3固体 ⑨NH4F溶液不能用玻璃瓶盛放。其中与盐类水解有关的是
A.全部 B.除②⑦以外 C.除②以外 D.除⑨以外
15.反应NH4HS(s) NH3(g)+H2S(g)在某温度下达到平衡,下列各种情况中,不
能使平衡发生移动的是
NH3(g)+H2S(g)在某温度下达到平衡,下列各种情况中,不
能使平衡发生移动的是
A.其它条件不变时,通入SO2气体 B.移走一部分NH4HS固体
C.容器体积不变,充入氮气 D.充入氮气,保持压强不变
14.已知一种c(H+)=1×10-3mol/L的酸和一种c(OH-)=1×10-3mol/L的碱溶液等体积混合后溶液呈酸性,其原因可能是
A.浓的强酸和稀的强碱溶液反应 B.浓的弱酸和稀的强碱溶液反应
C.等浓度的强酸和弱碱溶液反应 D.生成了一种强酸的碱盐
13. 一定条件下,将X和Y两种物质按不同比例放入密闭容器中,反应达到平衡后,测得X、Y转化率与起始时两种物质的量之比[n(X)/n(Y)]的关系如右图,则X和Y反应的方程式可表示为
一定条件下,将X和Y两种物质按不同比例放入密闭容器中,反应达到平衡后,测得X、Y转化率与起始时两种物质的量之比[n(X)/n(Y)]的关系如右图,则X和Y反应的方程式可表示为

 A.X+3Y 2Z B.3X+Y 2Z
A.X+3Y 2Z B.3X+Y 2Z

 C.3X+2Y Z D.2X+3Y 2Z
C.3X+2Y Z D.2X+3Y 2Z
12.用标准的NaOH溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作会导致实验结果偏低的是
①碱式滴定管用蒸馏水洗净后没有用标准液润洗 ②终点读数时俯视
③锥形瓶用蒸洗净后没用待测液润洗 ④滴定管尖端气泡没有排除,滴定后消失
⑤酸式滴定管用蒸馏水洗净后没有用待测液润洗 ⑥滴定结束溶液红色长时间不褪
A.②④⑥ B.①④⑥ C.②③⑤ D.②⑤
11. 密闭容器中,可逆反应nA(g) + mB(g) pC(g)已达到平衡状态已知n+m=p,正反应为放热反应。下列分析结论中正确的是
密闭容器中,可逆反应nA(g) + mB(g) pC(g)已达到平衡状态已知n+m=p,正反应为放热反应。下列分析结论中正确的是
①升温,c(B)/c(C)的值变小;②降温,平衡体系内混合气体的平均相对分子质量变小;③增加B的物质的量,A的转化率增大;④使用催化剂,气体总的物质的量不变;⑤加压使密闭容器的容积变小,A或B的浓度则变大;⑥若A的反应速率为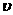 (A),则
(A),则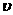 (B)=
(B)=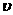 (A)n/m
(A)n/m
A.①②③ B.②③④ C.③④⑥ D.③④⑤
10. 在一密闭容器中,反应mA(g)+nB(g) pC(g),达到平衡时,测得c(A)为0.5 mol·L―1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L―1。则下列判断正确的是
在一密闭容器中,反应mA(g)+nB(g) pC(g),达到平衡时,测得c(A)为0.5 mol·L―1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L―1。则下列判断正确的是
A.化学计量数:m+n>p B.平衡向正反应方向移动了
C.物质B的转化率升高了 D.物质C的质量分数减少了
9.甲、乙两烧杯中各盛有100mL 3 mol/L的盐酸和NaOH 溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲∶乙=1∶2,则加入铝粉的质量为
A.5.4 g B.3.6 g C.2.7 g D.1.8 g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com