
题目列表(包括答案和解析)
1、下列说法正确的是( )
A、通常情况下,氮气的性质不活泼是因为氮元素的非金属性很弱的缘故
B、氮气是非极性分子,氨气是极性分子
C、白磷和红磷互为同素异形体,它们之间的相互转化为物理变化
D、五氧化二磷是磷酸的酸酐,二氧化氮是硝酸的酸酐
26.有三份不同质量的铁粉样品①②③,甲、乙、丙三位同学各取一份样品分别与含有0.8mol HNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只有NO。据此回答下列问题:
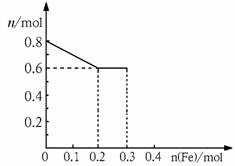 ⑴甲取样品①,反应后的溶液中铁只以Fe3+离子的形式
⑴甲取样品①,反应后的溶液中铁只以Fe3+离子的形式
存在,则样品①的质量为 ___________g。(2分)
⑵乙取样品②,反应后的溶液中既含有Fe3+、又含有Fe2+ 离子,则样品②的质量(设为ag)范围是 ____________________________。(2分)
⑶丙取样品③,将其慢慢加入到稀硝酸中,并不断搅拌,
反应过程中溶液里Fe3+、Fe2+、NO3-三种离子中的一种离子的物质的量的变化曲线如下图所示,则该曲线表示的是 ___________物质的量变化的曲线,请你在此图中再画出另外两种离子的物质的量的变化曲线。(6分)
25.NaOH和Ba(OH)2混合溶液的pH=14,取该溶液100mL,持续通入CO2,当CO2通入0.56L时,生成沉淀最多(气体体积均指标态,设溶液体积不发生改变),试通过计算回答:
⑴NaOH和Ba(OH)2的物质的量浓度是多少?(4分)
⑵当通入CO2的体积为1.68L时,溶液中各离子(除H+和OH-)物质的量浓度各是多少?(4分)
24.
 氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或
反之)。现有0.001mol/L酸性KMnO4和未知浓度的无色NaHSO3溶液,反应的离子方程式是:
2MnO4―+5HSO3―+H+=2Mn2++5SO42―+3H2O。填空回答问题:
氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或
反之)。现有0.001mol/L酸性KMnO4和未知浓度的无色NaHSO3溶液,反应的离子方程式是:
2MnO4―+5HSO3―+H+=2Mn2++5SO42―+3H2O。填空回答问题:
⑴该滴定实验所需仪器有下列中的_____________________________。(3分)
A.酸式滴定管(50mL) B.碱式滴定管(50mL) C.量筒(10mL)
D.锥形瓶 E.铁架台 F.滴定管夹 G.烧杯
H.白纸 I.胶头滴管 J.漏斗
⑵不用___________(酸、碱)式滴定管盛放KMnO4溶液,原因是_____________________________ __________________________。(共3分)
⑶指示剂如何选择,说明理由__________________________________________________。(2分)
⑷滴定前平视KMnO4液面,刻度为a mL,滴定后俯视液面刻度为b mL,则(b-a)mL比实际 消耗KMnO4溶液体积_____________(多、少)。根据(b-a)mL计算得到的待测液浓度,比实际浓度____________(大、小)。(共2分)
23.由短周期元素组成的单质A、B、C和甲、乙、 丙、丁、戊五种化合物有右图的转换关系,甲是工 业上制取A的主要原料。根据以上的转换关系回答:
⑴(4分)写出下列物质的化学式: A , 甲 ,乙 ,丁 。
⑵(2分)写出甲物质在工业上的任两种主要用途 、 。
⑶(6分)写出下列变化的化学方程式:
①A与NaOH溶液反应的化学方程式 。
②乙与过量CO2反应的离子方程式 。
③戊溶液与乙溶液混合的离子方程式 。
22.现有下列各坐标图:(各2分,共10分)
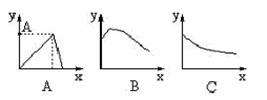
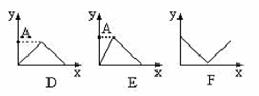
⑴x轴坐标代表加水量,y轴代表c(H+),能表示出0.1mol/L醋酸在稀释时的状况的坐标图是 。
⑵x轴代表在搅拌情况下向铝盐溶液中加入NaOH物质的量的多少,y轴代表混和物中沉淀量的变化,那么该坐标图应是 。
⑶x轴代表向1L 0.01mol/L石灰水中通入CO2的质量(g),y轴代表沉淀质量(g)的变化,符合这一情况的坐标图是 ,A点的数值为 g。
⑷x轴代表在氢氧化钡溶液中滴加硫酸的量,y轴代表溶液导电性的变化,符合这一关系的坐标图是 。
21.已知25℃时0.1mol·L-1醋酸溶液的pH约为3。向其中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的PH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
⑴你认为上述两种解释中 (“甲”或“乙”)正确。(2分)
⑵①为了验证上述哪种解释正确,继续做如下实验:向0.1mol·L-1的醋酸溶液中加入少量下列物质 (填写编号),然后测定溶液的pH。(2分)
A.固体CH3COOK B.固体CH3COONH4 C.气体NH3 D.固体NaHCO3
②按照你的判断,加入上述物质后,溶液pH应 (填“增大”或“减小”或“不变”)。(已知25℃时0.1mol·L-1氨水和0.1mol·L-1醋酸的电离程度相同)(2分)
20.将6mol H2和2mol N2混合后置于体积可变的等压容器中,在一定温度下发生如下反应:
 N2(g)+3H2(g) 2NH3(g)(反应放热),该反应达到平衡状态A时,测得气体的总物质的量
N2(g)+3H2(g) 2NH3(g)(反应放热),该反应达到平衡状态A时,测得气体的总物质的量
为7.6mol。若H2、N2、NH3的起始物质的量分别用a、b、c表示,回答下列问题:
⑴在达到平衡状态A的容器中通入少量N2,体系中N2的体积分数_____________(填“增大”
或“减小”或“不变”),若要使H2的体积分数再变到与平衡状态A相同,可采用的措施有
______________________________或___________________________________。
⑵若起始时a=3mol,b=1mol,且达到平衡后各气体的体积分数与平衡状态A相同,则起始时c的值为_______________(填“某一数值”或“任意值”)。
⑶若要使反应开始向逆反应方向进行,且达到平衡后各气体的物质的量与平衡状态A相同,
则起始时c的取值范围为____________________。
19.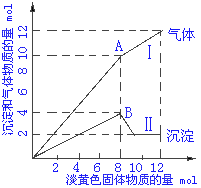 某溶液可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的数种,当向其中加入一种淡黄色固体
某溶液可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的数种,当向其中加入一种淡黄色固体
并加热时,有刺激性气味的气体放出并生成白色沉淀,加入淡黄色固体的物质的量(横坐标) 与生成气体,沉淀(纵坐标)的物质的量之间关系如下图所示。
⑴则加入的淡黄色的固体是__________________。(1分)
⑵溶液中含有的离子是______________________。(3分)
⑶各种离子之间的物质的量之比为______________。(2分) ⑷写出II曲线变化的有关离子方程式
。(6分)
第Ⅱ卷(非选择题,共78分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com