
题目列表(包括答案和解析)
9、足量的铁粉与一定量的盐酸反应,由于反应速率太快,为了减慢此反应速率而不减少H2的产量,可以加入的物质是( )
 A、盐酸
B、CH3COONa
C、Na2CO3
D、NaOH
A、盐酸
B、CH3COONa
C、Na2CO3
D、NaOH
8、下列事实中一定不能证明 CH3COOH是弱电解质的是( )
①常温下,某CH3COONa溶液的PH=8。② 用CH3COOH溶液做导电性实验,灯泡很暗。③ 等PH等体积的盐酸、醋酸溶液分别和足量锌反应,醋酸放出的氢气较多。④ 0.1mol/L的CH3COOH溶液PH=2.1。⑤ CH3COONa和H3PO4反应,生成CH3COOH。⑥ 氢离子浓度为0.1mol/L的CH3COOH溶液稀释100倍,PH<3
A、② B、②⑤ C、①③⑤⑥ D、①③④⑤⑥
7、250C时,浓度均为1mol/L 的 (NH4)2SO4,(NH4)2CO3,(NH4)2Fe(SO4)2溶液中,测得C(NH4+)分别为a,b,c(单位为mol.L-1),下列判断正确的是( )
A、a=b=c B、a>b>c C、c>a>b D、a>c>b
6、可逆反应2SO2(g)+O2(g)
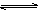 2SO3(g),在体积为2L的密闭容器中进行,如果SO2在某时刻的物质的量为4mol,2min后变为3.6mol,则用O2的浓度变化表示这段时间的反应速率为( )mol·(L·min)
-1
2SO3(g),在体积为2L的密闭容器中进行,如果SO2在某时刻的物质的量为4mol,2min后变为3.6mol,则用O2的浓度变化表示这段时间的反应速率为( )mol·(L·min)
-1
A、0.05 B、0.2 C、0.1 D、0.4
5、磷和氮处于同一主族,它们对应的化合物在结构上、性质上有许多相似之处。下列对化合物PH4I的描述正确的是( )
A、它是一种共价化合物 B、加热时不分解
C、不与AgNO3溶液反应 D、和消石灰共热可得PH3气体
4、下列各组气体通常状态下能稳定共存,并均能用浓硫酸干燥的是( )
A、NH3,O2,HCl B、NO,NO2,O2 C、N2,H2,HCl D、H2,N2,NH3
3、下列有关方程式书写正确的是( )
A、H2CO3的电离:H2CO3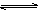 2H+
+CO32-
2H+
+CO32-
B、NaHCO3的水解:HCO3-+H2O 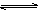 H3O++CO32-
H3O++CO32-
C、Cu与稀HNO3反应:Cu+4H++2NO3- = Cu2++2NO↑+2H2O
D、NH4Cl的水解:NH4++H2O
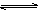 NH3·H2O+H+
NH3·H2O+H+
2、以下事实不能用勒夏特列原理解释的是( )
A、增大压强,有利于二氧化硫和氧气反应生成三氧化硫
B、工业制取硫酸和合成氨反应都要使用催化剂
C、合成氨工业生产中,把合成塔中的氨气不断抽出
D、实验室常用排饱和食盐水的方法收集氯气
1、下列说法正确的是( )
A、通常情况下,氮气的性质不活泼是因为氮元素的非金属性很弱的缘故
B、氮气是非极性分子,氨气是极性分子
C、白磷和红磷互为同素异形体,它们之间的相互转化为物理变化
D、五氧化二磷是磷酸的酸酐,二氧化氮是硝酸的酸酐
32、(6分)在763k,3.04×104kPa时,用CO和H2做原料合成甲醇(CH3OH),反应为:CO(g)+2H2(g)
 CH3OH(g) ,计算并填写下列空白(不要求写出计算过程)
CH3OH(g) ,计算并填写下列空白(不要求写出计算过程)
(1)设H2和CO的起始物质的量之比为m,平衡时CO的转化率为α,平衡混合气中甲醇的体积百分含量为y,则m,α,y三者的关系为 。
(2)已知m, α,y的部分数据,试计算出其它数据填在空格中,并分析反应物的最佳配比应为m= .
|
m |
α |
y |
|
1 |
0.25 |
16.67% |
|
2 |
0.45 |
21.43% |
|
3 |
|
19.35% |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com