
题目列表(包括答案和解析)
19.(8分)Ⅰ. _______________
Ⅱ. (1)_______________________。(2)____________。(3)__________。
26.(10分)已知可逆反应CO + H2O(g)  CO2 + H2,
CO2 + H2,
达到平衡时,K = ,K是常数,只与温度有关,与浓度无关。
,K是常数,只与温度有关,与浓度无关。
(1)830K时,若起始时:c (CO) = 2 mol/L,c (H2O) = 3 mol/L,平衡时CO的转化
率为60%,水蒸气的转化率为______________;K值为______________。
(2)830K,若只将起始时c (H2O)改为6 mol/L,则水蒸气的转化率为____________。
(3)若830K时,起始浓度c (CO) = a mol/L,c (H2O) = b mol/L,H2的平衡浓度
c (H2) = c mol/L,
①a、b、c之间的关系式是____________________________________;
②当a = b时,a = __________c。
高二期中考试化学试卷 命题:谢 忠
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷满分150分。考试时间120分钟。
第二卷(非选择题 共76分)
25.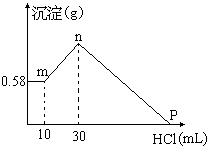 (8分)把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量的水中,有0.58g白色沉淀析出,向所得的浊液里,逐渐加入0.5mol/L的盐酸,加入盐酸的体积和生成沉淀的质量如图所示:
(1)混合物中NaOH的质量是__________________
(g);
(8分)把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量的水中,有0.58g白色沉淀析出,向所得的浊液里,逐渐加入0.5mol/L的盐酸,加入盐酸的体积和生成沉淀的质量如图所示:
(1)混合物中NaOH的质量是__________________
(g);
AlCl3的质量是__________________ (g);MgCl2的质量是__________________(g)。
(2)P点所表示盐酸加入体积是____________(mL)。
24、(10分)实验室为测定一新配的稀盐酸的准确浓度。通常用纯净的Na2CO3(无水)配成标准溶液进行滴定。具体操作是:称取W克纯净无水Na2CO3装入锥形瓶中,加适量的蒸馏水溶解。在酸式滴定管中加入待测盐酸滴定。
(1)由于CO2溶在溶液中会影响pH,为准确滴定,终点宜选在pH:4-5之间,那么在石蕊、甲基橙、酚酞三种指示剂中应选用 。当滴定至溶液由 色变为 色时,即表示到达终点。
(2)若达到滴定终点时,中和W克Na2CO3消耗盐酸VmL,则盐酸的物质的量的浓度为 mol/L。
(3)若所称取的Na2CO3不纯,则测得盐酸的浓度就不准确。现设盐酸的准确浓度为c1 mol/L,用不纯的Na2CO3标定而测得盐酸浓度为c2 mol/L。在下述情况下,c1与c2的关系是(填“>”或“<”或“=”):
①当Na2CO3中含有NaHCO3时,则c1 c2。
②当Na2CO3中含有NaOH时,则c1 c2。
23.(12分)某化学反应2A B+D在四种不同条件下进行B、D起始浓度为零,反应物A的浓度(mol/L),随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行B、D起始浓度为零,反应物A的浓度(mol/L),随反应时间(min)的变化情况如下表:

根据上述数据,完成下列填空:
(1)实验1,反应在10至20分钟时间内平均速率为____ __ ,
实验2中还隐含的条件可能是________________ ____;
(2)设反应速率实验3为 ,实验1为
,实验1为 ,若相同时间内
,若相同时间内 >
> ,则c3___1.0mol/L(填>、=、<
,则c3___1.0mol/L(填>、=、< ,理由是____________________
_____;
,理由是____________________
_____;
(3)该反应是________反应(选填吸热、放热),理由是_________________________.
22.(10分)Ⅰ.已知pH=2的高碘酸(H5IO6)溶液与pH=12的NaOH溶液等体积混合,所得溶液呈酸性;0.01 mol·L-1的HIO3或HMnO4溶液与pH=12的Ba(OH)2溶液等体积混合所得溶液均呈中性。
(1)H5IO6是 (填“强电解质”或“弱电解质”)。
(2)已知H5IO6和MnSO4在溶液中反应生成高锰酸、碘酸和硫酸,此反应中氧化剂
是 (填化学式)。
Ⅱ.已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是 ,上述四种离子浓度的大小顺序为 (填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为 ;若上述关系中④是正确的,则溶液中的溶质为 。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
c(NH3·H2O)(填“大于”、“小于”或“等于”,下同),混合前酸中c(H+)和碱中
c(OH-)的关系c(H+) c(OH-)。
21. (6分)

⑴ 在上面元素周期表中全部是金属元素的区域为___________。
(a)A (b)B (c)C (d)D
⑵现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都
生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
甲、乙两元素相比较,金属性较强的是______________(填名称),
可以验证该结论的实验是_____________________________(填编号)。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
20.(12分)Ⅰ.由于条件所限,仅有一大一小两支试管和稀硫酸,甲、乙两同学各找来铝制牙 膏皮,各自设计一种装置来制取一试管氢气。他们设计装置如图所示:
膏皮,各自设计一种装置来制取一试管氢气。他们设计装置如图所示:
(1)上述两装置相比,________(填“甲”或“乙”)装置设计
更合理。
(2)用较合理的装置来制取氢气,现欲使氢气充满收集气体的试
管,应采取的措施是__________。
(3)还可以用哪些物品代替牙膏皮或稀硫酸来完成反应?
_______________(填写一种物质即可)。
Ⅱ.为了验证铁与氧气在不同条件下的反应情况,设计如图所示(部分铁架台已略去)的实验,D装置是O2发生装置,A为铁在有水存在下与O2反应装置,B为无锈铁片在加热条件下与O2反应装置,C装置是验证在干燥条件下O2与铁反应装置(C装置事先干燥过)请回答下列问题:

|
(1)为了确保C装置按题干所述条件进行反应,还应在D、C之间加装_______________。
(2)各装置安装及铁片放置完毕后,开始实验,先打开C中的止水夹,其余操作步骤为______________________________________________________。
(3)一段时间后,停止反应,A、B、C中的铁片各有何现象?
________________________________________________________________________。
19.(8分)Ⅰ.下列有关仪器的使用,能实现的是_______________(填序号)
A.用托盘天平称取11.7g食盐 B.用量筒量取12.36ml盐酸
C.用酸式滴定管量取21.20ml 0.10mol/L H2SO4溶液
D.用200ml容量瓶配制500ml 0.1mol/L NaCl溶液
Ⅱ.现用物质的量浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,还应该进行的操作是_______________________。
(2)下图是酸式滴定管中液面在滴定前后的读数:

c (NaOH) = _______________________________________。
(3)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度会偏___________。
18. 如图是2004年批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子。电子经外电路、质子经内电路到达另一极与氧气反应。电池总反应式为:2CH3OH+3O2=2CO2+4H2O。
如图是2004年批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子。电子经外电路、质子经内电路到达另一极与氧气反应。电池总反应式为:2CH3OH+3O2=2CO2+4H2O。
下列说法中正确的是
A.右边的电极为电池的负极,b处通入的是空气
B.左边的电极为电池的负极,a处通入的是甲醇
C.电池负极的反应式为:CH3OH+H2O-6e-=CO2+6H+
D.电池的正极反应式为:O2+2H2O+4e-=4OH-
第二卷(非选择题 共76分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com