
题目列表(包括答案和解析)
25、(10分)
(1)Fe2O3。 (2)ZnO或Zn(OH)2 (3)①② (4)5:1(4分)
24、(11)
答案:(1)浓硫酸属于弱电解质,不能完全电离.(2分)
(2)在上层清夜 (或取少量上层清夜置于小试管) 中,滴加BaCl2溶液,如果不产生沉淀,说明沉淀已经完全.(2分)
(3)取一定体积的水置于烧杯中,将浓硫酸缓缓加入水中,边加边搅拌.(2分)
(4) ① ② (2分)
(5)17.8mol/L<18.4mol/L(3分)因此,该硫酸不合格.
23、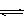 (9分)把一小块试纸放在表面皿(玻璃片)上,用蘸有待测溶液的玻璃棒点在试纸的中部,试纸变色后,与标准比色卡比较来确定溶液的PH。(2分)CO32-
+H2O H CO3-
+ OH- ,(2分) 7-13 。(2分),
(9分)把一小块试纸放在表面皿(玻璃片)上,用蘸有待测溶液的玻璃棒点在试纸的中部,试纸变色后,与标准比色卡比较来确定溶液的PH。(2分)CO32-
+H2O H CO3-
+ OH- ,(2分) 7-13 。(2分),
(2)(3分)向纯碱溶液中滴加酚酞溶液,溶液显红色;若再向该溶液中滴入过量氯化钙溶液,产生白色沉淀,且溶液红色褪去。说明纯碱溶液呈碱性是由CO32-引起的。
30. 在真空密闭容器内加入amolPH4I固体,在一定温度下发生如下反应:
PH4I(s)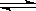 PH3(g)
+ HI(g)
PH3(g)
+ HI(g)
4PH3(g)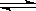 P4(g)
+ 6H2(g)
P4(g)
+ 6H2(g)
2HI(g)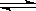 H2(g) + I2(g)
H2(g) + I2(g)
以上三反应建立平衡后,测得HI为bmol、I2(g)为cmol、H2为dmol。
求:
(1) 平衡后,容器内P4(g)和PH3的物质的量(用代数式表示):
n(P4))= ;n(PH3)=
(2)a、b、c三者服从a> (填b、c的代数式);
b、c、d三者的关系服从b> (填c、d的代数式)
(3)平衡后,增大压强,容器内n(I2) ,n(PH4I) (填增大、减小、不变)
化学试卷评分标准
29、(14分)t℃时,将3mol A和1molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g) + B(g)  xC(g)
xC(g)
2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
(1) 从开始反应至达到平衡的状态,生成C平均反应速率为 .
(2) x= ;平衡常数K= .
(3) 若继续向原混合物的容器中通入少量氦气(设氦气和A、B、C都不反应)后,化学平衡(填字母) ;
A、向正反应方向移动 B、向逆反应方向移动 C、平衡不移动
(4)若向原平衡混合物的容器中再充入amolC,在t℃时达到新平衡,此时B的物质的量为n(B)= mol。
(5)如果上述反应在相同温度和容器中进行,欲使反应达到C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为:
。
28、(12分)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A=H++HA- HA- 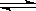 H++A2-
H++A2-
回答下列问题:
(1) Na2A溶液显____________(填“酸性”,“中性”,或“碱性”)。
理由是____________________________________________(用离子方程式表示)
(2) 在0.1mol.L-1的Na2A溶液中,下列微粒浓度关系式正确的是__________
A c(A2-) +c( HA-)+c( H2A) =0.1mol·L-1 B c(OH-)=c(H+) +c( HA-)
C c(Na+ )+ c(H+) =c(OH-)+ c( HA-)+2c(A2-) D c(Na+ )= 2c(A2-) +2c( HA-)
(3) 已知0.1mol·L-1NaHA溶液的pH=2,则0.1mol·L-1 H2A溶液中氢离子的物质的量浓度可能是_______ 0.11 mol·L-1(填“〈”,“〉”,或“=”),理由是:
____________________________________________________________
(4) 0.1mol·L-1 NaHA溶液中各种离子浓度由大到小的顺序是:____________________
26、(4分)已知:2H2(g)
+ O2(g) == 2H2O(g);△H= –483.6
kJ· , H2(g) + 1/2O2(g) == H2O(l)的△H=–285.8 kJ·
, H2(g) + 1/2O2(g) == H2O(l)的△H=–285.8 kJ· ,由此可知,在等温下蒸发45g液态水需吸收_____ kJ的热量。27、(3分)甲同学向自制的少量Mg(OH)2沉淀中加入浓的CH3COONH4溶液,结果沉淀完全溶解,已知CH3COONH4溶液显中性,试用有关理论解释这一事实:
,由此可知,在等温下蒸发45g液态水需吸收_____ kJ的热量。27、(3分)甲同学向自制的少量Mg(OH)2沉淀中加入浓的CH3COONH4溶液,结果沉淀完全溶解,已知CH3COONH4溶液显中性,试用有关理论解释这一事实:
25、(10分)
(1)把FeCl3溶液蒸干灼烧最后的产物是 。
(2)工业上制备纯净的氯化锌时,将含杂质的氯化锌溶于过量盐酸中,为了除去杂质需调节溶液的PH到4,应加入的试剂是 。
(3)3mol/L 100mL的H2SO4溶液与足量的Zn反应,为使产生的H2速率减慢,但产生H2的总量不变,可采取的措施 。(请填下列选项的序号)
①加固体CH3COONa ②BaCl2溶液 ③NH4Cl溶液 ④加氨水
(4)若1体积硫酸恰好与10体积PH=11的氢氧化钠的溶液完全反应,则二者物质的量浓度之比是 。
24、(11)如图某化学实验小组从商店买回的浓硫酸试剂标签的部分内容,该小组在课外资料中获得以下信息:浓硫酸腐蚀性很强,溶于水时释放大量的热,浓硫酸的硫酸分步电离。
|
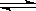 HSO4- + H+
HSO4- + H+
向HSO4- 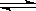 SO42- +
H+
SO42- +
H+
由于试剂瓶口密封签已破损,他们怀疑该硫酸质量分数与标签不符,确定开展研究.
甲认为可以用一种精密仪器测量该溶液的C(H+),若C(H+) =36.8 mol•L-1,该溶液的质量分数为0.98;
乙认为,即使有精密的仪器,甲方案也不行,建议用重量分析法来测。具体设想:取一定体积该硫酸和足量BaCl2反应,过滤、洗涤、干燥沉淀,称量沉淀的质量
丙则建议用“中和滴定”进行测量,设想如下:A、准确量取一定体积的硫酸,并用适量的水稀释;B、往稀释后溶液中滴入2-3滴酚酞;C、用一定浓度的NaOH溶液滴定,直到出现滴定终点为止;D、记录消耗的NaOH溶液的体积。
回答下列问题:。
(1)乙推断“甲同学方案不可行”的理由是: 。
(2)乙方案的关键操作有两点:①确保SO42-完全反应,②洗涤沉淀,确保沉淀不夹杂质。在实验中如何认定SO42-完全反应?
。
(3)如何稀释浓硫酸溶液?
。
(4)丙方案下列操作会使测定结果偏大 。
①在滴定前未用NaOH标准溶液润洗滴定管
②滴定前滴定管尖嘴部分有气泡,滴定后滴定管尖嘴部分气泡消失
③锥形瓶用水洗干净后,未用待测液润洗
④开始时平视读数,滴定完成时俯视读数
(5)丙在实验中,分别取硫酸5.00mL,用5.00mol/L NaOH滴定三次,终点时,得到的NaOH的体积依次为35.65mL、40.62mL、35.55mL,试通过计算该硫酸是否合格.(要计算过程)
23、(9分)现有0.1mol•L-1的纯碱溶液,试用PH试纸测定溶液的PH,其正确的操作是 。纯碱溶液呈碱性的原因(用离子方程式表示)是 - ,你认为该溶液PH的范围一定介于 。
为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案。
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com