
题目列表(包括答案和解析)
18.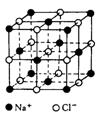 (12分)下面是一种简单可行的测定阿伏加德罗常数的步骤:
(12分)下面是一种简单可行的测定阿伏加德罗常数的步骤:
1将固体NaCl细粒干燥后,准确称取mgNaCl固体
并转移到定容仪器A中;
2用滴定管向A仪器中加苯,不断振荡,继续加苯
到A仪器的刻度,计算出NaCl固体的体积Vcm3。
请回答下列问题
(1)步骤11)中A仪器最好使用__C____(填序号)
A.量筒 B.烧杯 C.容量瓶 D.试管
(2)步骤2中用酸式滴定管还是用碱式滴定管____酸式滴定管___理由是_苯是优良的有机溶剂,会溶解碱式滴定管下端的橡胶管。
能否用水代替苯____不可以___理由是氯化钠会溶于水后的体积<水的体积+氯化钠固体的体积,导致测量氯化钠的体积不准确。
(3)已知NaCl晶体中,靠得最近的Na+与Cl-间的平均距离为acm(如右图),用上述测定方法测得的阿伏加德罗常数NA的表达式为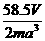 。
。
17、(7分)参考下表中各物质的熔点回答有关问题:
|
物质 |
NaF |
NaCl |
NaBr |
NaI |
NaCl |
KCl |
RbCl |
CsCl |
|
熔点(℃) |
995 |
801 |
755 |
651 |
801 |
776 |
715 |
646 |
|
物质 |
SiF4 |
SiCl4 |
siBr4 |
SiI4 |
SiCl4 |
GeCl4 |
SnCl4 |
PbCl4 |
|
熔点(℃) |
-90.2 |
-70.4 |
-5.2 |
12.5 |
-70.4 |
-49.5 |
-36.2 |
-15.0 |
(1)钠的卤化物及碱金属的氯化物的熔点与 离子键强弱 有关,随着 卤素离子半径增大,键长 增大键能减小,故熔点依次降低。
(2)硅的卤化物的熔点与 分子间作用力强弱 有关,随着 相对分子量 增大 分子间作用力 增大,故熔点依次升高。
(3)钠的卤化物的熔点比相应的硅的卤化物的熔点高得多,这与 晶体类型/微粒间作用力 有关,因为 离子晶体/离子键的强度远大于分子间作用力 ,故前者的熔点远高于后者。
16、(6分)有A、B、C三种物质,每个分子都各有14个电子.其中A的分子属于非极性分子,且只有非极性键:B的分子也属于非极性分子,但既有极性键,又有非极性键;C
的分子属于极性分子。则A的电子式为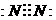 ,B的结构式为
,B的结构式为 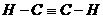 。C的名称是 一氧化碳 。
。C的名称是 一氧化碳 。
15、六氟化硫分子呈正八面体,难以水解,在高电压下仍有良好的绝缘性,在电器工业有着广泛用途,但逸散到空气中会引起强温室效应。下列有关SF6的推测正确的是 ( C )
A.SF6易燃烧生成二氧化硫
B.SF6中各原子均达到 8 电子稳定结构
C.高温条件下,SF6微弱水解生成H2SO4和HF
D.SF6是极性分子
14、硼能以B12正多面体基本结构单元接不同的连接方式形成多种单质晶体的变体。B12基本结构单元中含B原子12个,每个硼原子与邻近的5个硼原子等距离成键,每个面都是等边三角形,则B12正多面体的面数是 ( B )
A.10 B.20 C.30 D.60
13、下列晶体中,所含任何一个原子都被相邻的四个原子包围,以共价键形成正四面体结构,并向空间伸展形成网络状结构的是 ( C )
A.甲烷 B.石墨 C.单晶硅 D.水晶
12、X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z在地壳中的含量仅次于Y,W可以形成自然界最硬的原子晶体。下列叙述错误的是 ( D )
A.WX4是沼气的主要成分 B.固态X2Y是分子晶体 。
C.ZW是原子晶体 D.ZY2的水溶液俗称水玻璃
11、已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间均以单键结合,下列关于C3N4晶体的说法正确的是 ( C )
A.C3N4晶体是分子晶体
B.C3N4晶体中,C-N键的键长比金刚石中的C-C键的键长要长
C.C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子
D.C3N4晶体中微粒间通过离子键结合
10、将下列晶体熔化:氢氧化钠、二氧化硅、氧化钙、四氯化碳,需要克服的微粒间的相互作用有:①共价键 ②离子键 ③分子间的作用力正确的顺序是 ( B )
A.①②②③ B。②①②③ C.②③②① D。①①②③
9、下面有关晶体的叙述中,错误的是 ( C )
A.金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子
B.在NaCl晶体中每个Na+(或Cl-)周围都紧邻6个Cl-(或6个Na+)
C.白磷晶体中,微粒之间通过共价键结合,键角为60°
D.离子晶体在熔化时,离子键被破坏,而分子晶体熔化时,化学键不被破坏
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com