
题目列表(包括答案和解析)
3.下列有机物的命名正确的是
A.3,3-二甲基丁烷 B.2,2-二甲基丁烷
C.2-乙基丁烷 D.2,3,3-三甲基丁烷
2.下列说法中错误的是:
A.磺化、硝化、水化、风化、钝化等都是化学变化
B.干馏、常压分馏、减压分馏、都是物理变化
C.石炭酸不是有机酸,纯碱不是碱,干冰不是冰
D.水煤气、裂解气、焦炉气都是混合物
1.下列化学式中,只能用来表示一种物质的是
A.C2H4Cl2 B.C3H8O C.C D.C2H5Cl
22.(8分)在100mL bmol/L的AlCl3溶液中加入等体积a mol/L的NaOH溶液。
(1)当a、b满足 条件时无沉淀生成。
(2)当a≤3b时,生成Al(OH)3的物质的量为 。(用a或b的代数式表示)
(3)当a=0.2, b=0.1 时生成Al(OH)3的质量为多少?(该小题写出必要的计算过程)
高二年级化学上学期期末质量检查
21.(10分)以下是测定盐酸物质的量浓度的实验:① 首先用NaOH固体配制0.10mol·L-1
NaOH溶液1L;②将待测盐酸稀释10倍; ③取稀释后的盐酸10.00mL放入锥形瓶中;④滴入指示剂;⑤用 NaOH 标准溶液进行滴定;⑥滴定重复进行3次,求出滴定中所用标准溶液体积的平均值。根据以上操作,回答下列问题:
⑴从下列选项中选出①、③操作中各需要的任意一种仪器,用序号回答:
a. 胶头滴管 b.容量瓶 c.碱式滴定管 d.酸式滴定管 e.烧杯 f.烧瓶
①_________、③__________;
⑵该实验选用的指示剂最不适合的是_______;
A.甲基橙(3.1-4.4) B.酚酞(8-10) C.石蕊(5-8)
⑶如果碱式滴定管用水洗净后,未用标准溶液润洗,则 HCl 的物质的量浓度________(填“偏高”、“偏低”或“无影响”,下同),如果碱式滴定管读数时滴定前仰视滴定后俯视,则测定结果 HCl 的物质的量浓度_________。
⑷设⑥中的平均值为7.50mL,则未稀释时盐酸的物质的量浓度为___________mol/L;
20.(4分)今有①CH3COOH、②HCl、③H2SO4三种溶液,用序号回答下列问题
(1)当它们pH和体积相同时,与Fe反应的平均速率最快的是 。
(2)当它们物质的量浓度相同时,其pH最小的是 。
(3) 当它们的体积均为100 mL、pH均为4时,均加水900 mL稀释,则稀释后溶液的pH最小是 。
(4)当它们的pH和体积相同时,中和同浓度的NaOH所需NaOH溶液的体积最大是 。
19.Ⅰ.(6分)反应m A+n B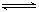 p C在某温度下达到平衡。
p C在某温度下达到平衡。
(1)若A、B、C都是气体,增大压强化学平衡向右移动,则m、n、p的关系是________________ 。
(2)若C为气体,且m + n = p,在加压时化学平衡发生移动,则平衡必定向______方向移动。
(3)如果在体系中只增加或减少B的量,平衡均不发生移动,则B肯定不能为_____态。
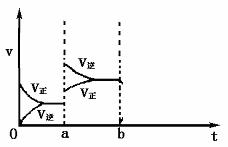
Ⅱ.(4分)下图表示密闭容器中:2SO2(g)+O2(g) 2SO3(g)(放热反应)在达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,则a时刻改变的条件可能是
; 若在b时刻增大压强,一段时间后达到平衡,请在下图相应位置画出该反应速率变化情况。
2SO3(g)(放热反应)在达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,则a时刻改变的条件可能是
; 若在b时刻增大压强,一段时间后达到平衡,请在下图相应位置画出该反应速率变化情况。
18.(8分)提示:某些金属氧化物跟熔融烧碱反应可生成盐。根据以下化学反应框图填空:

(1)单质F是________________。
(2)写出A与B反应的化学方程式:___________________________________。
(3)溶液I中所含金属离子是___________、____________。
(4)写出溶液E中通入Cl2反应的离子方程式:_________________________。
17.Ⅰ.(4分)下列四组物质中, 互为同位素; 是同素异形体; 是同分异构体; 是同系物。(填数字序号)
① O2和O3 ② 35Cl 和37Cl ③ CH3CH3和CH3CH2CH2CH3
④CH3CH2CH2CH(CH3)CH2CH3 和 CH3CH2CH(CH3)CH(CH3)CH3
Ⅱ. (8分)已知  可简写为
可简写为  ,降冰片烯的分子结构可表示为:
,降冰片烯的分子结构可表示为: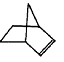
(1)降冰片烯属于__________。
a.苯的同系物 b.不饱和烃 c.烷烃 d.芳香烃
(2)降冰片烯的分子式为__________。
(3)降冰片烯具有的性质为__________。
a.能溶于水 b.能发生氧化反应 c.能发生加成反应 d.常温常压下为气体
(4)降冰片烯与等物质的量的H2加成,写出该加成产物的任意一种同分异构体(要求该同分异构体为含有3个甲基的炔烃)的结构简式为______________。
16.下列各项中的两个量,其比值一定为2 : 1的是
A.在反应2FeCl3+Fe=3FeCl2中,氧化剂与还原剂的物质的量
B.相同温度下,0.2mol·L-1CH3COOH溶液中c(H+)与0.1mol·L-1CH3COOH溶液中c(H+)
 C.在密闭容器中,反应N2(g)+3H2(g)
2NH3(g)已达平衡时的c(NH3)与c(N2)
C.在密闭容器中,反应N2(g)+3H2(g)
2NH3(g)已达平衡时的c(NH3)与c(N2)
D.液面均在“0”刻度时,50mL碱式滴定管和25mL碱式滴定管所盛溶液体积
第II卷(非选择题,共52分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com