
题目列表(包括答案和解析)
4、滴定操作
左手操作滴定管,右手摇动锥形瓶,眼睛注意观察锥形瓶中溶液颜色变化,到最后一滴刚好使指示剂颜色发生改变,且半分钟不再变化为止,记下刻度读数。
再重复上述操作一次或两次。(定量分析的基本要求)
终点的判断方法:最后一滴刚好使指示剂颜色发生改变,半分钟不再变化
3、滴定前准备
(1)检查滴定管是否漏液
(2)玻璃仪器洗涤:
①水洗
②用标准液润洗装标准液的滴定管
③用待测液润洗装待测液的滴定管
(3)向用标准液润洗过的滴定管中装入标准液。调整液面到0刻度或0刻度以下(注意O刻度在上方),排除滴定管尖嘴部分气泡,记下刻度读数。
(4)往锥形瓶中加入一定体积(一般为20.00mL)的待测液
注意:锥形瓶只能用蒸馏水洗 ,一定不能用待测液润洗,否则结果会偏高,锥形瓶取液时要用滴定管(或用相应体积规格的移液管),不能用量筒。
(5)向锥形瓶中加入2滴指示剂。
指示剂的选择
指示剂的颜色变化要灵敏,变色范围最好接近等当点,且在滴定终点由浅色变深色,即:碱滴定酸宜用酚酞作指示剂,酸滴定碱宜用甲基橙作指示剂(滴定过程中一般不能用石蕊作指示剂)。
注意:指示剂用量不能过多,因指示剂本身也具有弱酸性或弱碱性,会使滴定中耗标准液量增大或减小,造成滴定误差。
2、试剂:标准浓度的溶液,待测浓度的溶液,指示剂。
1、仪器:酸式滴定管、碱式滴定管、烧杯、滴定管夹、锥形瓶、铁架台。
2、概念:用已知物质的量浓度的酸(或碱)测定未知物质的量浓度的碱(或酸)的方法叫中和滴定。
1、实质:H++OH-=H2O
酸、碱有强弱之分,但酸、碱中和反应的实质不变。
例:HCl+NaOH=NaCl+H2O
CH3COOH+NaOH=CH3COONa+H2O
H2SO4+2NH3·H2O=(NH4)2SO4+2H2O
反应中,起反应的酸、碱物质的量之比等于它们的化学计量数之比。
例如:2NaOH+H2SO4=Na2SO4+2H2O
由 H2SO4---------NaOH
1mol 2mol
C酸·V酸 C碱·V碱
则C碱= 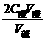
24、实验室常用盐酸的质量分数为36.5%,密度为1.20g/㎝3。
⑴此浓盐酸的物质的量浓度是多少?(列式计算)
⑵配制100mL3.00mol/L的盐酸,需以上浓盐酸多少mL ?(列式计算)
⑶用浓盐酸配制该稀盐酸需要以下哪些步骤(按操作顺序填写序号): 。
①计算 ②装瓶③用50 mL量筒量取一定体积的浓盐酸④洗涤⑤移液⑥稀释⑦定容⑧摇匀
23、甲、乙两人分别用不同的方法配制100ml 3.6mol/L的稀硫酸。
(1)甲:量取20 ml 18 mol/L浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100 ml 容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
① 实验所用的玻璃仪器除烧杯和胶头滴管外,还有的玻璃仪器有 , , ;
(2)乙:用100 ml 量筒量取20 ml 浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加入水至100 ml 刻度线,再搅拌均匀。
你认为此法是否正确?若不正确,指出其中错误之处 , , 。
22、选择下列实验方法分离物质,将分离方法的序号填在横线上。A.萃取分液B.升华C.结晶D.分液 E.蒸馏 F.层 析 G.过滤
(1)______分离饱和食盐水与沙子的混合物。
(2)______从硝酸钾和氯化钠的混合液中获得硝酸钾。
(3)______分离水和汽油的混合物。
(4)______分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。
21、下列4组物质均有一种物质的类别与其它3种不同
A.CaO、Na2O、CO2、CuO B.H2、C、P、Cu
C.O2、Fe、Cu、Zn D.HCl、H2O、H2SO4、HNO3
(1)以上四组物质中与别不同的物质依次是(填化学式)A ;B ;C ;D 。
(2)这四种物质相互作用可生成一种新物质(碱式碳酸铜,化学式Cu2(OH)2CO3),该反应 氧化还原反应(填“是”或“否”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com