
题目列表(包括答案和解析)
20、通过中和滴定实验测定25.00mL未知浓度的H2SO4与23.80mL 0.42mol/L的NaOH溶液恰好完全中和,试计算H2SO4的物质的量浓度。
19、维生素C的分子式是C6H8O6,水溶液呈酸性,高温或较长时间受热易损耗,许多新鲜水果、蔬菜、乳制品中都含有丰富的维生素C,例如:新鲜橙汁中含维生素C浓度在500mg·L-1左右。
某校化学课外活动小组进行测定果汁中维生素C含量实验,下面是他们的实验过程及分析报告,请根据此报告填写有关空白。
(1)实验目的:测定××牌软包装鲜橙汁维生素C含量。
(2)实验原理:C6H8O6+I2→C6H6O6+2H++2I-。
(3)实验用品和试剂:
①仪器和用品(自选,略)
②试剂:浓度为7.50×10-3mol·L-1的标准碘(水)溶液,指示剂,蒸馏水等。
(4)实验过程:
①洗涤仪器,检查是否漏液,用标准液润洗后装好标准液待用。在此步操作中,需用蒸馏水洗涤的仪器有 。用标准液润洗的仪器是 。
②打开橙汁包,目测:颜色-橙黄色,澄清度-好,将仪器 该橙汁润洗2-3遍,移取20.00mL橙汁入锥形瓶,向瓶中加入2滴指示剂,该指示剂的名称是 。
③用左手操作滴定管,右手摇动锥形瓶,眼睛注视 。滴定至终点时的现象是 。
(5)数据记录和处理:(设计出表格,将三次滴定所得数据都填入表格中),若经数据处理,滴定中消耗标准碘溶液体积平均值为20.00mL,则此橙汁中维生素C的含量是 mg·L-1。
(6)问题讨论:
①从测定结果看,此软包装橙汁是否是纯天然橙汁 (填序号)
A、可能是 B、一定是 C、不是
②制造商可能采取的作法是 (填序号)
A、天然橙汁被加水稀释 B、天然橙汁被浓缩
C、向天然橙汁中添加维生素C D、用水和其原料混合制作
③对上述结论,你的意见是 (填序号)
A、向新闻界公布 B、向有关部门反映
C、继续实验 D、调查后再作结论
18、某同学为测定某烧碱样品中含NaOH的纯度(设样品中杂质为NaCl),进行如下实验:
(1)称取样品:调节托盘天平到零点后,在天平两盘放质量大小相同纸片,使天平保持平衡,向左盘放一个5g砝码,将游码拨0.2g处;向右盘纸片上缓缓小心加烧碱颗粒到天平达平衡。该操作的错误之处有: 。按如上操作,该同学称取烧碱样品的实际量应是 。
(2)配制溶液:将纸片上的烧碱样品小心移入100mL容量瓶中,加蒸馏水到刻度,盖紧瓶塞,反复倒置摇匀,该操作的错误是 。按此方法所配制得的溶液浓度应 (从“偏高”或“偏低”等词中选填)
(3)取液:将用蒸馏水洗净的锥形瓶再用所配制碱液润洗2-3次,再用蒸馏水洗净的移液管取10mL所配碱液移入锥形瓶,再向瓶中加入约15mL蒸馏水将碱液稀释。此操作中错误之处是 。
(4)滴定:向锥形瓶中加入约2mL酚酞溶液,用浓度为0.5mol·L-1的盐酸标准液进行滴定,滴定时左手操作滴定管,右手猛力振荡锥形瓶,当锥形瓶中溶液颜色刚变粉红色时,停止滴定,记下耗酸体积数,此步操作中错误之处是 。
将(3)(4)操作重复一次
(5)计算:取两次操作耗标准酸液体积平均值为20.00mL,依此数据计算出烧碱样品中含NaOH的质量分数为 。
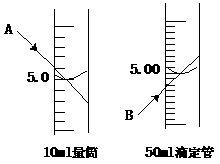
17、A同学用10mL量筒量取某液体,读数时视线偏高(如下图),该同学所得读数是 , B同学向50mL滴定管中加入某种液体,在调整液面高度后,读数时视线偏低(如下图),该同学所得读数是 。
16、用某种量器对一种液体进行体积测量,设正确的读数为n mL,仰视读数为x mL,俯视读数为y mL。若x>n>y,则所用量器是( )
A、量筒 B、滴定管 C、容量瓶 D、移偏管
15、两人用同一瓶标准盐酸滴定同一瓶NaOH溶液,甲将锥形瓶用NaOH待测液清洗后,使用水洗后后的移液管移取碱液于锥形瓶中;乙则用甲用过的移液管取碱液于刚用蒸馏水洗过的尚残留有蒸馏水的锥形瓶中,其它操作及读数全部正确,你的判断是( )
A、甲操作有错 B、乙操作有错
C、甲测得的数值一定比乙小 D、乙测得的值较准确。
14、用0.01mol/L NaOH溶液滴定0.01mol/L的H2SO4溶液中和后加水到100mL。若滴定时终点判断有误差:①多加了一滴NaOH,②少加了一滴NaOH。(设1滴为0.05mL),则①和②溶液中C(OH-)之比值是( )
A、1 B、10-4 C、104 D、4×104
13、下列仪器中,没有“0”刻度线的是( )
A、温度计 B、量筒 C、滴定管 D、容量瓶
12、关于锥形瓶在中和滴定中的作用和使用方法的下列说法中,错误的是( )
A、用于盛装被滴定的溶液
B、使用前用蒸馏水洗后还必须用待测液润洗
C、若瓶中装入被滴定溶液量太少,可向瓶中加入一定量蒸馏水稀释
D、滴定时,应用左手依顺时针方向旋摇锥形瓶
11、下列说法中,正确的是( )
A、酸碱中和反应的实质是H++OH-=H2O
B、酸碱中和反应的离子方程式,都可用H++OH-=H2O表示
C、当酸碱完全中和时,两者物质的量一定相等
D、当酸碱完全中和时,所得盐溶液pH值不一定等于7
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com