
题目列表(包括答案和解析)
规律一:恒温恒容条件下,对于反应前后气体分子数改变的反应,只改变起始时加入物质的物质的量,通过可逆反应的化学计量数比换算成同一半边的物质的物质的量(即把一边“归零”),与原平衡相等,则两平衡等效。
2SO2(g)+O2(g)  2SO3(g)
2SO3(g)
途径1起始 2mol 1mol 0
途径2起始 0 0 2mol
途径3起始 1mol 0.5mol 1mol
途径4起始 0.5mol ? ?
途径5起始 amol bmol cmol
[问题]: ①途径2、 3与1等效吗?
②途径4 中O2(g) 和 SO3(g)的起始量为多少, 平衡时可与途径1平衡时SO3(g)的含量相同?
③途径5中a、b符合怎样的关系达到的平衡状态与1相同?
[例2]恒温恒容时,判断哪些是等效平衡? ( A B D )
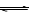 N2 + 3H2 2NH3
N2 + 3H2 2NH3
A.2mol 6mol 0mol
B. 0mol 0mol 4mol
C. 0.5mol 1.5mol 1mol
D. 1mol 3mol 2mol
[例3].将2molSO2(g)和2molSO3(g)混合于某固定体积的容器中,在一定条件下达平衡。平衡时SO3(g)为wmol,同温下,分别按下列配比在相同体积的容器中反应,达平衡时SO3(g)的物质的量仍为wmol的是( )
A 2molSO2(g)+1mol O2(g)
B 4mol SO2(g)+ 1mol O2(g)
C 2mol SO2(g)+ 1mol O2(g)+ 2mol SO3(g)
D 3mol SO2(g)+1.5mol O2(g)+ 1mol SO3(g)
[例4]在一个固定容积的密闭容器中加入2molA和1molB,发生反应2A(g)+B(g)≒3C(g)+D(g),达到平衡时,C的浓度为wmol/L。若维持容器的容积和温度不变,按下列情况配比为开始浓度,达到平衡后C的浓度仍为wmol/L的是( )
A、4molA+2molB
B、2molA+1molB+3molC+1molD
C、3molC+1molD+1molB
D、3molC+1molD
E、1molA+0.5molB+1.5molC+0.5molD
规律二:在恒温恒容条件下,对于反应前后气体分子数不变的可逆反应,通过可逆反应的化学计量数比换算成同一半边的物质的物质的量(即把一边“归零”),与原平衡相等只要反应物(或生成物)的物质的量的比例与原平衡相同,两平衡等效。
[例1] 在定温定容条件下,发生如下反应
H2(g)+I2(g)
 2HI(g)
2HI(g)
途径1 1 mol 1mol 0
途径2 0mol 0 2mol
途径3 2mol 2mol 0
途径4 0mol 0mol 4mol
上述途径与1是否等效?
[讲述]:途径3可认为是同温同容时两个途径1,每个都与1等效然后加压平衡不移动,所以与1等效(见图)

|
|
|
|
恒温恒容,发生反应
H2(g)+I2(g)  2HI(g)
2HI(g)
途径1 2 mol 1mol 0
途径2 1mol 0 1mol
途径3 4mol 2mol 0
途径4 3mol 1mol 2mol
上面与途径1等效的有________________
[例2]将装有1molHI的容器密封并加热,部分HI分解成H2和I2(g)并达到化学平衡。此时I2(g)的体积分数为x%,若在该容器中加入2molHI后密封,加热到相同温度使之达到平衡,设此时I2的体积分数为y%,则x与y的关系为( )。
A. 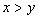 B.
B. 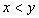 C.
C.  D.
D. 
规律三:在恒温恒压时,此时各不相同的起始状态,也可以把一边“归零”换算成同一半边,只要各物质的物质的量之比相同,则两平衡等效可以把一边“归零”换算成同一半边,只要各物质的物质的量之比相同,则两平衡等效
[例1]如果定温定压条件下,
2SO2(g) + O2(g)  2SO3(g)
2SO3(g)
途径1起始 2mol 1mol 0
途径2起始 4 mol 2 mol 0
途径1和2是否为等效平衡?
|
|
|
若反应为:H2(g)+
I2(g)  2HI(g)
2HI(g)
途径1 2 mol 1mol 0
途径2 4mol 2mol 0
|
|
|
同步练习
1.可逆反应A(g)+B(g)  2C(g),在固定容积的容器中进行。若向容器中充入1molA和1mol B,在某温度下达到平衡时,C的体积分数为n%,若向容器中充入2molA和3mol B,在某温度下达到平衡时,C的体积分数为m%则m和n的正确关系为 ( )
2C(g),在固定容积的容器中进行。若向容器中充入1molA和1mol B,在某温度下达到平衡时,C的体积分数为n%,若向容器中充入2molA和3mol B,在某温度下达到平衡时,C的体积分数为m%则m和n的正确关系为 ( )
A . m>n B. m<n C . m=n D. 无法比较
[引言]一定温度下密闭容器中发生反应:1L容器800℃时可逆反应
CO(g) + H2O(g)  CO2(g)+ H2(g)
CO2(g)+ H2(g)
途径1:起始 0.01mol 0.01mol 0 0
平衡 0.004mol 0.004mol 0.006mol 0.006mol
途径2:起始 0 0 0.01mol 0.01mol
平衡 0.004mol 0.004mol 0.006mol 0.006mol
上述两种途径,同一可逆反应;外界条件相同;通过不同的途径(正向和逆向);平衡时同种物质的物质的量相等(同种物质的含量相等)-----效果相同的平衡
对于同一个可逆反应,在相同的条件下(恒温恒容或恒温恒压),不管是从正反应开始,还是从逆反应开始,或从正反应和逆反应同时开始,都可以建立同一平衡状态。即化学平衡状态与条件有关,而与建立平衡的途径无关
等效平衡: 同一可逆反应当外界条件一定时,反应无论从正反应开始还是从逆反应开始,平衡时平衡混合物中同种物质的含量(体积分数或物质的量分数)相同的状态.
21、解:Ca2++C2O42-=CaC2O4↓
CaC2O4+H2SO4=CaSO4+H2C2O4
2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
设血样中含Ca2+物质的量浓度为x,
由以上化学反应方程式可得关系式为:
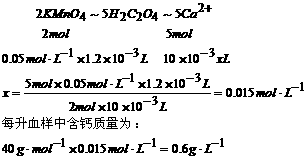
20、解:

19、(4)①酸式滴定管、锥形瓶、酸式滴定管 ②酸式滴定管、淀粉溶液 ③锥形瓶中溶液颜色变化。溶液变浅兰色半分钟不褪。
(5)1056
(6)①C ②C、D ③C、D
18、(1)3处:①称量易吸湿潮解或腐蚀性药品,不能放到纸上,而应用玻璃器皿盛装 ②砝码与药品在天平两端位置错放,应该左盘放称量物,右盘放砝码 ③称量NaOH等易潮解性药品不能缓慢操作,而应迅速称量。 <4.8g
(2)容量瓶不能用于作固态物溶解的器皿,特别不能用于溶解过程中热效值变化大的物质溶解或浓溶液稀释。正确的操作是将NaOH固体在烧杯中溶解,经复温后才能移入容量瓶,还必须再经洗涤,移液,定容等过程,才能得浓度较准确的溶液。总体偏低
(3)2处:①锥形瓶水洗后不能再用待测液润洗 ②移液管取液前除水洗外,还必须经所要移取的溶液润洗2-3次。
(4)3处:①指示剂酚酞试液量取用过多,只能用1-2滴 ②摇动锥形瓶不能用力过猛,以免造成瓶中液体溅出瓶外 ③指示剂选择最好用甲基橙,并且变色应稳定在半分钟以上,若溶液刚变色即停止滴定,并不能说明瓶中试剂已均匀混合充分反应,此处指示剂变色点选择不适当,应当是看到加入一滴酸液时溶液刚巧由红色褪成无色并半分钟不变色。
(5)83.33%
解析:由C酸·V酸=C碱·V碱
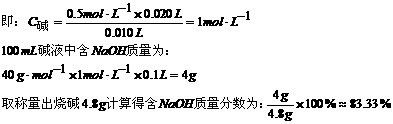
17、5.2 5.20
11、A、D 12、B、D 13、B、D 14、C 15、A、D 16、B
1、C 2、D 3、D 4、B 5、B 6、D 7、C 8、D 9、D 10、D
21、为测定人体血液中Ca2+的含量,有人设计如下方案:
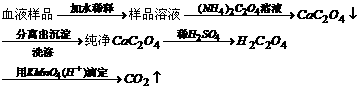
若血样为10mL,消耗0.05mol·L-1 KMnO4(H+)溶液1.2mL,问:试写出有关反应方程式并计算出该血样中的含钙量(用g·L-1表示)。
同步测试答案:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com